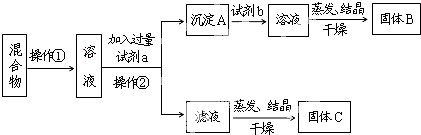
题目内容
1.已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:(1)B、D的元素名称分别为:碳、钠;
(2)E在周期表中的位置为:第三周期第ⅤⅡA族,
(3)C离子的结构示意图为:
 ;
;(4)B、C、D三种元素的原子半径从大到小的顺序为Na>C>O(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:HClO4>H2CO3(用对应的化学式表示)
(6)写出C、D两种元素组成的一种既有离子键又有共价键的常见化合物的电子式:
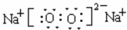 ;
;(7)写出E与水反应的离子方程式:Cl2+H2O?H++Cl-+HClO.
分析 A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,则A为氢元素,B、C组成的某一种化合物能引起温室效应,则B为碳元素,C为氧元素,常温下,金属D单质投入水中能与水剧烈反应,则D为钠元素,常温下E单质是常见的气体,E的原子序数大于钠,则E为氯元素.
解答 解:A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,则A为氢元素,B、C组成的某一种化合物能引起温室效应,则B为碳元素,C为氧元素,常温下,金属D单质投入水中能与水剧烈反应,则D为钠元素,常温下E单质是常见的气体,E的原子序数大于钠,则E为氯元素.
(1)由上述分析可知,B、D的元素名称分别为碳元素和钠元素,故答案为:碳;钠;
(2)E是氯元素,在周期表中第三周期第ⅤⅡA族,故答案为:第三周期第ⅤⅡA族;
(3)C为氧元素,氧离子的结构示意图为 ,故答案为:
,故答案为: ;
;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故B、C、D三种元素的原子半径从大到小的顺序为Na>C>O,
故答案为:Na>C>O;
(5)元素非金属性越强,对应的最高价氧化物对应水化物的酸性就越强,由于氯的非金属性强于碳,所以HClO4的酸性强于H2CO3,故答案为:HClO4>H2CO3;
(6)C、D两种元素组成的一种既有离子键又有共价键的常见化合物为过氧化钠,它的电子式为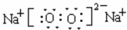 ,故答案为:
,故答案为: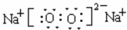 ;
;
(7)氯气与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO.
点评 本题主要考查了原子结构示意图、电子式、化学方程式、元素周期律等知识点,题目比较基础,有利于基础知识的巩固.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
9.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述不正确的是( )
| A. | Y的原子序数比X的大 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
10.下列玻璃仪器洗涤方法正确的是( )
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 做碘升华实验后的烧杯用酒精洗涤 | |
| C. | 盛装苯酚后的试管用盐酸洗涤 | |
| D. | 用KClO3和MnO2制取O2后的试管用水洗涤 |
11.下列反应的离子方程式正确的是( )
| A. | 碳酸氢镁溶液中加入足量的烧碱:HCO3-+OH-=CO32-+H2O | |
| B. | 铝粉投入到烧碱溶液中:Al+2OH-=AlO2-+H2↑ | |
| C. | 铁粉加到足量的稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 向FeSO4和KSCN溶液滴加酸化的H2O2溶液,立即变红:2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3 |

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2NaCl
+2NaCl 有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为
有多种同分异构体,其中含有苯环且苯环上只有两个取代基的同分异构体的数目为11(不含本身),其中核磁共振氢谱有3种峰的结构简式为



 .
.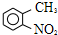 路线如下:
路线如下: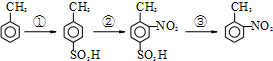 (反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.
(反应条件略).推测该路线中磺酸基的作用防止甲基对位被硝基取代.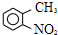 互为同分异构体,并同时满足下列条件的有机物有
互为同分异构体,并同时满足下列条件的有机物有 (写结构简式).
(写结构简式).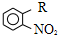 为原料,制取
为原料,制取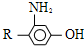 ,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e.
,-R 基为d(填编号,下同)最合适;反应的合理顺序是f→e. 合成
合成 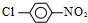 的化学方程式
的化学方程式 +HCl,
+HCl, $→_{△}^{浓硝酸、浓硫酸}$
$→_{△}^{浓硝酸、浓硫酸}$
 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)