题目内容
11.下列各组溶液中,c(NO3-)与200mL0.2mol•L-1Na2SO4溶液中的c(SO42-)相同的是( )| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
分析 200mL0.2mol•L-1Na2SO4溶液中的c(SO42-)=0.2mol/L,微粒浓度与溶液体积无关,强电解质溶液中离子浓度=溶质浓度×离子数.
解答 解:200mL0.2mol•L-1Na2SO4溶液中的c(SO42-)=0.2mol/L,
A.l00mL0.4 mol•L-1KNO3溶液中c(NO3-)=0.4mol/L,故A错误;
B.100mL0.2mol•L-1Cu(NO3)2溶液中c(NO3-)=0.4mol/L,故B错误;
C.200mLO.l mol•L-1Fe(NO3)2溶液c(NO3-)=0.2mol/L,故C正确;
D.400mLO.l mol•L-1Al(NO3)3溶液中c(NO3-)=0.3mol/L,故D错误;
故选C.
点评 本题考查了浓度计算,注意微粒浓度和溶液体积无关,强电解质溶液中离子浓度=溶质浓度×离子数的计算,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
19.下列物质属于化合物的是( )
| A. | 空气 | B. | 氧气 | C. | 食盐水 | D. | 二氧化锰 |
6.电解硫酸铜溶液要达到如下三个要求:①阳极质量减小 ②阴极质量增加 ③电解过程中Cu2+浓度不变,则可选用的电极是( )
| A. | 石墨作阳极,铁作阴极 | |
| B. | 粗铜(含Fe、Ni、Zn)作阳极,纯铜作阴极 | |
| C. | 纯铜作阳极,铁作阴极 | |
| D. | 铁作阳极,纯铜作阴极 |
16.同温同压下,等体积的O2和CO2相比较,下列叙述正确的是( )
| A. | 质量比为11:8 | B. | 原子个数之比为2:3 | ||
| C. | 物质的量之比为3:2 | D. | 密度之比为8:11 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,8g甲烷中含C-H键的数目为4NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 1 mol冰醋酸和1mol乙醇经催化加热反应生成H2O的分子数为NA | |
| D. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA |
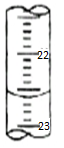 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: