题目内容
17. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由红色变为无色,且30S内不变色;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化;
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶,由此造成的测定结果偏高 (填偏高、偏低或无影响)
(4)步骤②缺少的操作是蒸馏水洗后应该再用标准溶液润洗
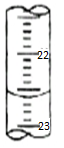
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
分析 (1)根据滴定终点,锥形瓶中的溶液颜色发生变化,且半分钟内不褪色;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以要用标准溶液润洗;
(5)根据滴定管的结构和精确度.
解答 解:(1)用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30S内不变色;
故答案为:红色变为无色,且30S内不变色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达,故答案为:锥形瓶内溶液颜色的变化;
(3)根据用待测溶液润洗锥形瓶,会使待测液的物质的量增多,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,可知c(待测)偏高;
故答案为:用待测溶液润洗锥形瓶;偏高;
(4)将酸式滴定管用蒸馏水洗净后,立即向其中注入标准稀溶液,则标准溶液的浓度偏小,所以缺少的操作为:蒸馏水洗后应该再用标准溶液润洗;故答案为:蒸馏水洗后应该再用标准溶液润洗;
(5)滴定管0刻度在上面,下面依次增大,精确度为0.01ml,则滴定管中的液面的读数为22.60mL,故答案为:22.60.
点评 本题主要考查了酸碱中和滴定的操作、误差分析等,难度中等,掌握中和滴定的原理是解题的关键.

练习册系列答案
相关题目
10.下列各化合物的命名不正确的是( )
| A. | 2-甲基-4-己烯 | B. | 2,2-二甲基戊烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 2-甲基-4-乙基庚烷 |
11.下列各组溶液中,c(NO3-)与200mL0.2mol•L-1Na2SO4溶液中的c(SO42-)相同的是( )
| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
5.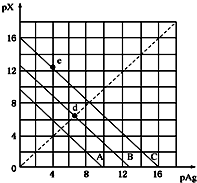 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解 | |
| B. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
12.化学与生产、生活息息相关,下列叙述正确的是( )
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
9.下列各有机物的名称错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2,2-二甲基丙烷 | D. | 3-甲基-1-丁炔 |
 .
.
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.