题目内容
16.同温同压下,等体积的O2和CO2相比较,下列叙述正确的是( )| A. | 质量比为11:8 | B. | 原子个数之比为2:3 | ||
| C. | 物质的量之比为3:2 | D. | 密度之比为8:11 |
分析 同温同压下气体摩尔体积相同,根据n=$\frac{V}{{V}_{m}}$可知二者具有相等的物质的量,
A.根据m=nM计算出二者的质量之比;
B.根据二者物质的量之比及分子组成计算出原子物质的量之比,从而可知原子个数之比;
C.二者的物质的量相等,物质的量之比为1:1;
D.相同条件下气体的密度与摩尔质量成正比.
解答 解:相同条件下气体摩尔体积相等,根据n=$\frac{V}{{V}_{m}}$可知O2和CO2具有相同的物质的量,
A.根据m=nM可知二者质量与摩尔质量成正比,则二者的质量之比=32g/mol:44g/mol=8:11,故A错误;
B.原子个数与原子的物质的量成正比,则二者含有原子个数之比=(1×2):(1×3)=2:3,故B错正确;
C.根据分析可知,二者的物质的量相等,则物质的量之比为1:1,故C错误;
D.同温同压下,气体密度之比等于摩尔质量的之比,二者密度之比为:32g/mol:44g/mol=8:11,故D正确;
故选BD.
点评 本题考查阿伏伽德罗定律及推论的应用,题目难度不大,明确同温同压下物质的量之比=体积比=分子数之比是解答的关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
6.下列叙述正确的是( )
| A. | ${\;}_{\;}^{13}$O和14O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 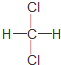 和 和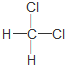 互称同分异构体 互称同分异构体 |
7.下列物质中所含的分子数相等的是( )
①0.1mol CO2
②9.8g H2SO4
③1g H2O
④1.6g O2.
①0.1mol CO2
②9.8g H2SO4
③1g H2O
④1.6g O2.
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
4.回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:
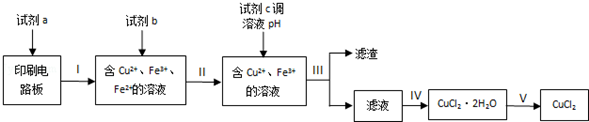
已知部分物质开始沉淀和沉淀完全时的pH如下表:
请回答下列问题:
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320kJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
(1)回收利用印刷电路板上的铜制备CuCl2.
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
①步骤Ⅲ的操作名称是过滤.
②下列试剂中,可以作为试剂a的是C.
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?否(填“是”或“否”),理由是不能除去Fe2+,影响所得CuCl2纯度.
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜.
已知:2H2O2(l)=2H2O (l)+O2(g)△H1=-196kJ/mol
H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H2=+286kJ/mol
Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)△H3=+64kJ/mol
则Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l)△H=-320kJ/mol.
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是H2O2+2H++2e-=2H2O.
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5mol/L的硝酸溶液的体积是4L.
11.下列各组溶液中,c(NO3-)与200mL0.2mol•L-1Na2SO4溶液中的c(SO42-)相同的是( )
| A. | l00mL0.4 mol•L-1KNO3溶液 | B. | 100mL0.2mol•L-1Cu(NO3)2溶液 | ||
| C. | 200mLO.l mol•L-1Fe(NO3)2溶液 | D. | 400mLO.l mol•L-1Al(NO3)3溶液 |
5.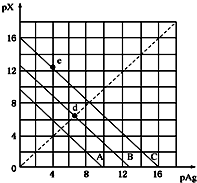 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解 | |
| B. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
3.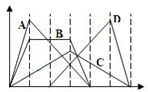 图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
 图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A. | 向NaAlO2溶液中逐渐滴入HCl至过量 | |
| B. | 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 | |
| C. | 向澄清石灰水中通入CO2至过量 | |
| D. | 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
 .
.