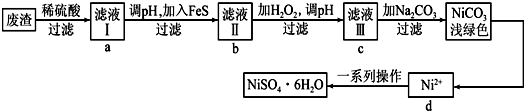
题目内容
9.鉴别乙醛溶液和乙醇溶液,使用的试剂是( )| A. | 金属钠 | B. | 浓硫酸 | C. | 银氨溶液 | D. | 氢氧化钠 |
分析 乙醛含-CHO,与银氨溶液发生银镜反应;乙醇含-OH,能与Na反应生成氢气,以此来解答.
解答 解:A.与Na反应生成气体的为乙醇,无现象的为乙醛,可鉴别,故A选;
B.二者均与浓硫酸不反应,不能鉴别,故B不选;
C.发生银镜反应的为乙醛,无现象的为乙醇,可鉴别,故C选;
D.二者均与NaOH溶液不反应,不能鉴别,故D不选;
故选AC.
点评 本题考查有机物的鉴别,为高频考点,把握有机物的官能团与性质、有机反应及现象为解答的关键,侧重分析与实验能力的考查,注意有机物的结构与性质,题目难度不大.

练习册系列答案
相关题目
19.若阿伏加德罗常数的值为NA,则下列说法中正确的是( )
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
3.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
20.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
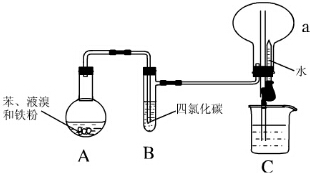 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.