题目内容
3.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
分析 Ⅰ.(1)实验①和②的浓度不同;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答;
Ⅱ.(3)实验时可以通过测量相同时间内产生O2的体积;
(4)探究不同浓度的Fe3+对H2O2分解的催化效果,双氧水的浓度,用量相同,催化剂的浓度不同来设计.
解答 解:Ⅰ.(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响,
故答案为:浓度;
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率;
Ⅱ.(3)通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量相同时间内产生O2的体积或(产生相同体积氧气所需的时间),
故答案为:相同时间内产生O2的体积(产生相同体积氧气所需的时间);
(4)探究不同浓度的Fe3+对H2O2分解的催化效果,双氧水的浓度,用量相同,催化剂的浓度通过水体积变化来体现Fe3+浓度变化,溶液的总体积保持一致为(a+b+c)mL,设计如下表:
| 物理量 实验序号 | V[30% H2O2]/mL | V[0.1mol?L-1 Fe2(SO4)3]/mL | V[蒸馏水]/mL | t[时间]/s | V[O2]/mL |
| 1 | a | b | c | t | V1 |
| 2 | a | c | b | t | V2 |
| 物理量 实验序号 | V[30% H2O2]/mL | V[0.1mol?L-1 Fe2(SO4)3]/mL | V[蒸馏水]/mL | V[O2]/mL | t[时间]/s |
| 1 | a | b | c | V | t1 |
| 2 | a | c | b | V | t2 |
| 物理量 实验序号 | V[30% H2O2]/mL | V[0.1mol?L-1 Fe2(SO4)3]/mL | V[蒸馏水]/mL | t[时间]/s | V[O2]/mL |
| 1 | a | b | c | t | V1 |
| 2 | a | c | b | t | V2 |
| 物理量 实验序号 | V[30% H2O2]/mL | V[0.1mol?L-1 Fe2(SO4)3]/mL | V[蒸馏水]/mL | V[O2]/mL | t[时间]/s |
| 1 | a | b | c | V | t1 |
| 2 | a | c | b | V | t2 |
点评 本题考查影响化学反应速率的因素,试题能够较好的考查学生实验设计、数据处理、图象分析的综合能力,注意掌握温度、浓度、催化剂等因素对化学反应速率的影响,题目难度中等.

练习册系列答案
相关题目
11.下列离子方程式书写不正确的是( )
| A. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| B. | 氢氧化钠溶液与稀盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
12.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L Na2CO3溶液:c(OH-)+c(H+)═c(HCO3-)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)+c(Cl-)═0.2mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=4的混合溶液:c(Na+)═c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
9.鉴别乙醛溶液和乙醇溶液,使用的试剂是( )
| A. | 金属钠 | B. | 浓硫酸 | C. | 银氨溶液 | D. | 氢氧化钠 |
16.下列化学用语正确的是( )
| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
8.H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.
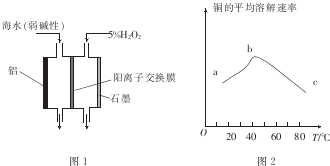
(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
①记录的数据为收集相同体积气体所需的时间(或相同时间内收集气体的体积).
②上表中V3=15.2.

(1)常温下,用CO、O2和水在三苯基膦钯的催化下即可制得H2O2.相对于电解氢氧化钠溶液制H2O2,该方法具有的优点是安全、能耗低.
(2)图1是铝/过氧化氢电池结构示意图.铝电极为负极(填“正极”或“负极”),石墨电极的电极反应式为H2O2+2e-=2OH-
(3)印刷电路板中的金属铜可用10%的H2O2溶液和3.0mol.L-l的H2S04溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示.其中bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验.将表中所给的溶液分别加入A、B、C、D 4个反应瓶中,收集产生的气体,记录数据.
| 实验 体积/mL 液体 | A | B | C | D |
| 0.4mol.L-1Fe2(SO4)3溶液 | 0 | 1.8 | 2.0 | V1 |
| 30%H2O2溶液 | 20.0 | 20.0 | 20.0 | 20.0 |
| HO2 | V2 | V3 | 15.0 | 13.8 |
②上表中V3=15.2.
15.下列指定微粒的数目不相等的是( )
| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
12.下列物质中既能与酸性KMnO4溶液反应,又能与溴水反应的一组物质是( )
①苯 ②苯乙烯 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸
⑧聚丁二烯 ⑨聚乙烯 ⑩聚乙炔.
①苯 ②苯乙烯 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸
⑧聚丁二烯 ⑨聚乙烯 ⑩聚乙炔.
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
13.下列有关物质用途的说法中,不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 碳酸氢钠可用于治疗胃酸过多 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Cl2可用于制漂白粉 |