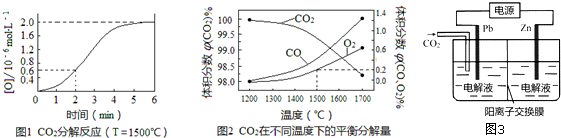
题目内容
4.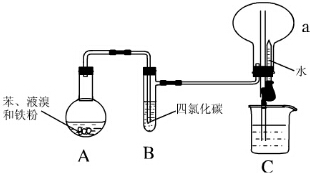 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.实验步骤如下:①按如图所示的装置连接好仪器;②检查装置的气密性;③在装置A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞;④将烧瓶a中气体收集满后,向烧杯中加水,挤压预先盛有水的胶头滴管,观察实验现象.
请回答下列问题:
(1)装置A中发生反应的化学方程式为C6H6+Br2 $\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)能证明装置A中发生的反应为取代反应的实验现象是烧瓶a中产生喷泉现象.
(3)装置B的作用是吸收挥发出的苯及溴蒸气.
(4)为除去溴苯中混有的少量溴,常向混合物中加入的试剂是NaOH(填化学式),充分振荡,静置后再分液(填操作名称).
Ⅱ.下列实验设计或操作合理的是BCDF.
A.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
D.将10滴溴乙烷加入1mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时现加生石灰后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度
F.为了减缓电石和水的反应速率,可用饱和食盐水来代替.
分析 Ⅰ.(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成;
(2)能证明装置A中发生的反应为取代反应,需要证明反应产物中生成溴化氢气体;
(3)反应放热,苯和溴易挥发,随产物挥发,通过装置B中四氯化碳会吸收苯和溴蒸气;
(4)为除去溴苯中混有的少量溴,常向混合物中加入的试剂是氢氧化钠溶液,振荡静置分层后分液进行分离;
Ⅱ.A.苯和液溴发生取代反应,和溴水不发生反应;
B.苯不溶于水比水轻,硝基苯不溶于水比水重,乙醇和水混溶;
C.实验室制备乙烯需要测定反应混合溶液的温度;
D.溴乙烷在强碱水溶液中水解生成溴化钠,溶液中加入硝酸银会生成淡黄色沉淀;
E.蒸馏是利用温度计测定流出成分的沸点,水银球应在蒸馏烧瓶的支管口处;
F.电石与水反应非常剧烈,为了减慢反应速率可用饱和食盐水代替水反应.
解答 解:Ⅰ.(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,化学反应为:C6H6+Br2 $\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2 $\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)能证明装置A中发生的反应为取代反应,需要证明反应产物中生成溴化氢气体,溴化氢极易溶于水,若生成溴化氢在装置C的a处烧瓶中会发生喷泉现象,
故答案为:烧瓶a中产生喷泉现象;
(3)反应放热,苯和溴易挥发,随产物挥发,相似相容原理可知,通过装置B中四氯化碳会吸收苯和溴蒸气,
故答案为:吸收挥发出的苯及溴蒸气;
(4)为除去溴苯中混有的少量溴,常向混合物中加入的试剂是氢氧化钠溶液,Br2+2NaOH=NaBr+NaBrO+H2O,溴苯不溶于水,振荡静置分层后分液进行分离,
故答案为:NaOH;分液;
Ⅱ.A.苯和液溴发生取代反应,和溴水不发生反应只出现萃取,故A错误;
B.苯不溶于水比水轻,硝基苯不溶于水比水重,乙醇和水混溶,只用水就能鉴别苯、硝基苯、乙醇,上层为苯,中间层为乙醇溶液,下层为硝基苯,故B正确;
C.实验室制备乙烯需要测定反应混合溶液的温度,使我的迅速升高到170°C,防止其他温度下生成副产物,故C正确;
D.溴乙烷在强碱水溶液中水解生成溴化钠,有机物中溴原子变化为溴离子,溶液中加入硝酸银会生成淡黄色沉淀,检验溴元素的存在,故D正确;
E.蒸馏是利用温度计测定流出成分的沸点,水银球应在蒸馏烧瓶的支管口处,不能插入混合溶液,故E错误;
F.制取乙炔实验中常利用饱和食盐水代替水反应,是为了减缓反应速度,故F正确;
故答案为:BCDF.
点评 本题考查了溴苯的实验制备、反应类型的实验验证、注意实验基本操作的理解应用,掌握基础是解题关键,题目难度中等.

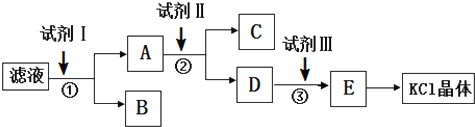
| A. | 起始滤液的pH=7 | |
| B. | 步骤②中加入试剂 II的目的是除去CO32- | |
| C. | 试剂 I为Ba(NO3)2溶液 | |
| D. | 试剂Ⅲ为稀盐酸 |
| A. | 0.1mol/L Na2CO3溶液:c(OH-)+c(H+)═c(HCO3-)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)+c(Cl-)═0.2mol/L | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=4的混合溶液:c(Na+)═c(NO3-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
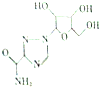 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
| A. | 金属钠 | B. | 浓硫酸 | C. | 银氨溶液 | D. | 氢氧化钠 |
| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
| A. | 铜片、铜片、稀硫酸 | B. | 铜片、石墨棒、硝酸银溶液 | ||
| C. | 锌片、铜片、稀硫酸 | D. | 铜片、银片、FeCl3溶液 |