题目内容
15.短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:I:常见双原子单质分子中,X分子含共价键最多.
II:甲分子中含10个电子,乙分子含有18个电子.
(1)化合物丙中阳离子的检验方法是在样品溶液中滴加氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,若有能使红色石蕊试纸变蓝的气体产生,则样品中含有铵根离子,否则没有铵根离子.
(2)实验室可用图2所示装置(夹持固定装置略去)加热化合物丙和另一种化合物制备并收集甲.
①写出试管内发生的化学反应方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)NH3•H2O?NH4++OH-.
③将甲的浓溶液滴加至某物质中可快速制备甲,该物质可能为bc.
a.浓硫酸b.碱石灰c.氧化钙d.氯化镁(3)X、Y中的元素可组成具有18个电子的分子,请写出该分子化学式N2H4.
分析 常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,丙为NH4Cl,以此解答该题.
解答 解:见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,二者反应生成离子化合物,应为铵盐,则化合物甲为NH3,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,丙为NH4Cl,
(1)由上述分析可知,化合物丙中阳离子这铵根离子,检验铵根离子的方法是在样品溶液中滴加氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,若有能使红色石蕊试纸变蓝的气体产生,则样品中含有铵根离子,否则没有铵根离子,
故答案为:在样品溶液中滴加氢氧化钠溶液,加热,用湿润的红色石蕊试纸检验,若有能使红色石蕊试纸变蓝的气体产生,则样品中含有铵根离子,否则没有铵根离子;
(2)①试管中是制备氨气的反应,所选的试剂是NH4Cl和Ca(OH)2,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气极易溶于水,烧杯中形成一水合氨溶液,一水合氨存在电离生成铵根离子和氢氧根离子,即NH3•H2O?NH4++OH-,显碱性,遇到酚酞由无色变为红色,
故答案为:NH3•H2O?NH4++OH-;
③实验中将氨水的浓溶液滴加至碱石灰或氧化钙中可快速制备氨气,故选bc;
(3)X为N2,Y为H2,X、Y中的元素可组成具有18个电子的分子为N2H4,故答案为:N2H4.
点评 本题考查了物质性质的分析判断,转化关系和物质性质是解题关键,掌握物质性质和特征反应产物的分析判断,实验制备气体的装置选择和性质验证,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 由Y、M两种元素组成的化合物是离子化合物 | |
| C. | M的简单气态氢化物的热稳定性比Z的弱 | |
| D. | 原子半径:r(M)<r(W)>r(Z)<r(Y)<r(X) |
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
 向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )
向AlCl3溶液中逐滴加入NaOH溶液,如图,曲线①、②分别表示两种物质的物质的量的变化.其中正确的是( )| A. | ①Al3+ ②Al(OH)3 | B. | ①Al3+ ②AlO2- | ||
| C. | ①Al(OH)3 ②Al3+ | D. | ①AlO2- ②Al3+ |
| A. | 1个氢气分子的实际质量约为(1/NA )g | |
| B. | 含NA个氧原子的氧气在标准状况下的体积约为22.4 L | |
| C. | 过氧化钠与水反应,每产生标准状况下11.2 L O2,转移NA个电子 | |
| D. | 1 mol Na 原子中约含有NA个电子 |
| A. | 卤代烃不是烃 | B. | 含羟基的化合物一定是醇 | ||
| C. | 芳香烃不是烃 | D. | 含醛基的化合物一定是醛 |
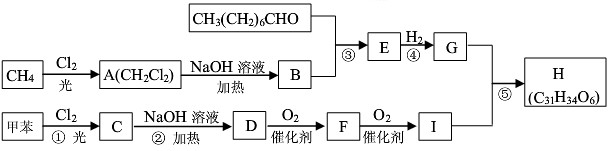
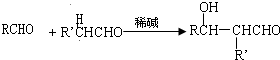
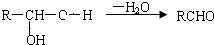
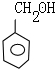 ,E
,E .
. .
.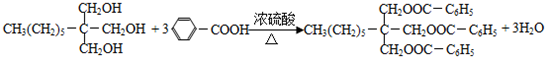 .
.