题目内容
6.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 由Y、M两种元素组成的化合物是离子化合物 | |
| C. | M的简单气态氢化物的热稳定性比Z的弱 | |
| D. | 原子半径:r(M)<r(W)>r(Z)<r(Y)<r(X) |
分析 X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,以此解答该题.
解答 解:X、Y、Z、W、M五种短周期元素,Y的单质晶体熔点高、硬度大,是一种重要的半导体材料,可知Y为Si;X、Y、Z、W同周期,都处于第三周期,由X+与M2-具有相同的电子层结构,可知X为Na、M为O;Z、M同主族,则Z为S;离子半径Z2->W-,则W为Cl,
A.X、M两种元素形成的化合物可以形成Na2O、Na2O2,故A错误;
B.Y为Si,M为O元素,二者形成的化合物为共价化合物,故B错误;
C.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.一般来说,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则原子半径r(O)<r(Cl)>r(S)<r(Si)<r(Na),故D正确.
故选D.
点评 本题考查位置结构性质的关系和应用,为高考常见题型,侧重于学生的分析能力的考查,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可,难度不大.

练习册系列答案
相关题目
12.下列说法中正确的是( )
| A. | 同时含有分子和离子的电解质溶液,一定是弱电解质溶液 | |
| B. | pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室温时,pH=3的硫酸和pH=11的氨水等体积混合,混合溶液的pH>7 |
14.正确认识官能团有助于了解有机物的性质,下列有关物质官能团的说法正确的是( )
| A. | 油脂分子中都含有碳碳双键 | B. | 葡萄糖分子中含有羟基和醛基 | ||
| C. | 水分子中含有羟基 | D. | 乙酸乙酯分子中含有羧基 |
1.在氯化钡溶液中通入SO2,无白色沉淀产生.若将氯化钡溶液分装在两只试管中,一支加硝酸,另一支加NaOH溶液,然后再分别通入适量的SO2,结果两支试管中都有白色沉淀生成.由此得出下列结论正确的是( )
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化钡有两性 | ||
| C. | 两支试管中的白色沉淀都是BaSO4 | D. | SO2具有两性且水溶液有酸性 |
16.同温同压下,下列各热化学方程式中反应热数值最小的是 (均为吸热反应)( )
| A. | 2A(g)+B(g)═2C(l)△H=+Q3 kJ•mol-1 | B. | 2A(g)+B(g)═2C(g)△H=+Q2 kJ•mol-1 | ||
| C. | 2A(l)+B(l)═2C(g)△H=+Q1 kJ•mol-1 | D. | 2A(l)+B(l)═2C(l)△H=+Q4 kJ•mol-1 |
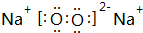 (用电子式表示)
(用电子式表示)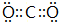 (用电子式表示)
(用电子式表示)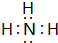 .
.