题目内容
2.除去FeCl2溶液中的FeCl3所需试剂是( )| A. | Cl2 | B. | Cu | C. | Fe | D. | NaOH |
分析 Fe能与氯化铁反应生成氯化亚铁,可用于除杂,以此解答该题.
解答 解:因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁,如果加入金属铜,会向溶液中引入杂质离子,加入氯气,与氯化亚铁反应,而加入硫氰化钾溶液,引入新杂质.
故选C.
点评 本题考查物质的分离、提纯方法及选择,为高频考点,把握物质的性质及分离原理为解答的关键,注意物质性质差异及分离方法的选择,题目难度不大.

练习册系列答案
相关题目
12.四种短周期元素在周期表中的相对位置如表所示,其中 Z 元素原子核外电子总数是其 最外层电子数的 3 倍.下列说法中不正确的是( )
| X | Y | |
| Z | W |
| A. | X、Y 均能形成不止一种氢化物 | |
| B. | YO 2是一种有毒气体,属于酸性氧化物 | |
| C. | Y 的最简单氢化物比 Z 的稳定性更强 | |
| D. | XW2中各原子最外层均达到 8e-稳定结构 |
13.短周期元素W、X、Y、Z的原子序数依次增大,W、Z同主族.X2-与Y+离子的电子层结构相同,Z的单质可用作太阳能也池的光电转换材料.下列说法错误的是( )
| A. | 原子半径:X<W<Z<Y | |
| B. | 简单氢化物的稳定性:X>W>Z | |
| C. | 氢元素与W、X形成的相对分子质量最小的酸分子式为H2WX3 | |
| D. | X与Y形成的两种二元化合物中,阴、阳离子数之比均为1:2 |
10.某有机物结构如图,它不可能具有的性质是( )


| A. | 能跟KOH溶液反应 | B. | 能被氧化 | C. | 能发生加聚反应 | D. | 能使溴水褪色 |
17.测定含有少量氯化钠小苏打(主要成分为NaHCO3)的含量有多种方法.
(1)I.用重量法.加热法样品,用化学方程式表示的反应原理是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
II.量气法:通过测得CO2的体积,从而通过换算求得小苏打的含量.
(2)III.滴定法(容积法)反应原理:NaHCO3+HCl→NaCl+H2O+CO2↑,
NaHCO3呈弱碱性,故不宜用酚酞做指示剂,而常用甲基橙作指示剂.用标准盐酸滴定样品,滴定终点时的现象是滴入最后一滴盐酸,溶液由黄色突然变为橙色并在半分钟内不变色,滴定法实验步骤如图示

(3)“称量→溶解、定容”这两大步骤需要的仪器主要有:电子天平、药匙、100mL的容量瓶、烧杯、胶头滴管、玻璃棒等
(4)“取出20mL”使用的滴定管在水洗后没对其进行润洗,对滴定结果的影响是偏低(“偏高”“偏低”“无影响”);
必须“做二次实验”的理由减少误差.
某化学兴趣小组的同学用重量法测定某品牌小苏打中NaHCO3的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如表所示.
试计算:
(5)生成的质量CO22.2g;样品中的NaHCO3的质量分数93.3%(计算结果保留一位小数)
(1)I.用重量法.加热法样品,用化学方程式表示的反应原理是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
II.量气法:通过测得CO2的体积,从而通过换算求得小苏打的含量.
(2)III.滴定法(容积法)反应原理:NaHCO3+HCl→NaCl+H2O+CO2↑,
NaHCO3呈弱碱性,故不宜用酚酞做指示剂,而常用甲基橙作指示剂.用标准盐酸滴定样品,滴定终点时的现象是滴入最后一滴盐酸,溶液由黄色突然变为橙色并在半分钟内不变色,滴定法实验步骤如图示

(3)“称量→溶解、定容”这两大步骤需要的仪器主要有:电子天平、药匙、100mL的容量瓶、烧杯、胶头滴管、玻璃棒等
(4)“取出20mL”使用的滴定管在水洗后没对其进行润洗,对滴定结果的影响是偏低(“偏高”“偏低”“无影响”);
必须“做二次实验”的理由减少误差.
某化学兴趣小组的同学用重量法测定某品牌小苏打中NaHCO3的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如表所示.
| 物质 | 样品 | 消耗的稀盐酸 | 反应后的溶液 |
| 质量(g) | 4.5g | 37.7g | 40g |
(5)生成的质量CO22.2g;样品中的NaHCO3的质量分数93.3%(计算结果保留一位小数)
7.将Na2O2与过量NaHCO3混合固体在密闭容器中充分加热反应后,排出气体后最终剩余固体是( )
| A. | NaOH和Na2O2 | B. | NaOH和Na2CO3 | C. | Na2CO3 | D. | Na2O2 |
14.黄酒酿造过程中有部分乙醇最终转化为具有芳香气味的物质,该过程中发生的反应有( )
| A. | 还原反应 | B. | 氧化反应 | C. | 加成反应 | D. | 聚合反应 |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol-CH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合,生成物中含有NA个分子 | |
| C. | 物质的量相等的Na2O2和Na2O所含有的阴离子数目为NA | |
| D. | H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移2NA个电子 |
 ,名称是乙烯.
,名称是乙烯. ,名称是聚乙烯.
,名称是聚乙烯.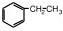 、
、 .
. .属于取代反应反应类型.
.属于取代反应反应类型.