题目内容
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 1mol-CH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合,生成物中含有NA个分子 | |
| C. | 物质的量相等的Na2O2和Na2O所含有的阴离子数目为NA | |
| D. | H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移2NA个电子 |
分析 A、甲基中含9个质子;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
C、过氧化钠和氧化钠的物质的量不明确;
D、在H2O2+Cl2═2HCl+O2反应中,氧元素由-价变为0价.
解答 解:A、甲基中含9个质子,故1mol甲基中含9NA个质子,故A错误;
B、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,故标准状况下,22.4LNO和11.2LO2混合,生成物中分子个数小于NA个,故B错误;
C、过氧化钠和氧化钠的物质的量不明确,故其含有的阴离子不一定是NA个,故C错误;
D、在H2O2+Cl2═2HCl+O2反应中,氧元素由-价变为0价,故生成32g氧气即1mol氧气时,转移2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
2.除去FeCl2溶液中的FeCl3所需试剂是( )
| A. | Cl2 | B. | Cu | C. | Fe | D. | NaOH |
20.下列元素位于d区的是( )
| A. | C | B. | Ca | C. | Cr | D. | Ga |
7.在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2.下列分析不正确的是( )
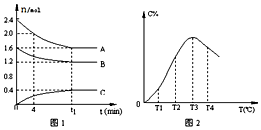

| A. | t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变 | |
| B. | 该反应的平衡常数表达式K=$\frac{c(C)}{{c}^{2}(A)•c(B)}$ | |
| C. | 由T1向T2变化时,V正>V逆 | |
| D. | 此反应的正反应为放热反应 |
17.“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2$?_{充电}^{放电}$2Na2CO3+C.下列叙述错误的是( )
| A. | 放电时,Na+由负极向正极移动 | |
| B. | 充电时,阴极反应式为Na++e-═Na | |
| C. | 电解质溶液可选NaClO4水溶液 | |
| D. | 电池放电时把二氧化碳变废为宝,有重要的研发意义 |
4.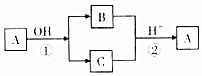 A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
 A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )| A. | A可能是金属,也可能是非金属 | B. | A、B、C含有一种相同的元素 | ||
| C. | B、C的水溶液一定都呈碱性 | D. | 反应①②不一定都是氧化还原反应 |
1.已知:25℃时,电离常数Kb(NH3•H2O)=1.8×10-5,CH3COOH的电离常数与其相等.现向1L 0.1mol•L-1氨水中加入等体积的0.1mol•L-1CH3COOH溶液,则下列说法正确的是( )
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
2.下列关于石油的说法正确的是( )
| A. | 石油属于可再生矿物能源 | B. | 石油主要含有碳、氢两种元素 | ||
| C. | 石油裂化属于物理变化 | D. | 石油分馏属于化学变化 |