题目内容
下列物质中,不能通过化合反应直接生成的是( )
| A、FeS |
| B、Fe(OH)3 |
| C、FeCl2 |
| D、Al(OH)3 |
考点:铁的化学性质,两性氧化物和两性氢氧化物
专题:
分析:A.铁与硫反应可生成硫化亚铁;
B.可由氢氧化亚铁和氧气、水反应生成;
C.铁与氯化铁反应生成氯化亚铁;
D.氧化铝和水不能发生化合反应生成氢氧化铝.
B.可由氢氧化亚铁和氧气、水反应生成;
C.铁与氯化铁反应生成氯化亚铁;
D.氧化铝和水不能发生化合反应生成氢氧化铝.
解答:
解:A.铁与硫反应可生成硫化亚铁,发生化合反应,故A不选;
B.氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B不选;
C.铁与氯化铁反应生成氯化亚铁,发生化合反应,故C不选;
D.氧化铝和水不能发生化合反应生成氢氧化铝,故D选.
故选D.
B.氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式4Fe(OH)2+O2+2H2O═4Fe(OH)3,故B不选;
C.铁与氯化铁反应生成氯化亚铁,发生化合反应,故C不选;
D.氧化铝和水不能发生化合反应生成氢氧化铝,故D选.
故选D.
点评:本题综合考查元素化合物知识,明确物质的性质是解本题关键,注意常见物质的性质以及反应类型的判断,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应.二者比较,相等的是(溶液体积变化忽略不计)( )
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
| A、①③ | B、②④ | C、③④ | D、只有① |
把200mL NH4HCO3和Na2CO3的混合溶液分成二等份,取一份加入含a mol氢氧化钠的溶液加热,恰好使NH4+完全转化为NH3逸出,另取一份加入含b molHCl的盐酸恰好反应完全生成CO2,则该混合溶液中c(Na+)为( )
A、(
| ||||
| B、(2b-a) mol/L | ||||
C、(5b-
| ||||
| D、(10b-5a) mol/L |
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所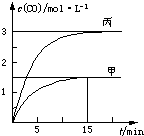 示.下列说法正确的是( )
示.下列说法正确的是( )
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所
 示.下列说法正确的是( )
示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V>0.5L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
钠与水反应的现象与钠的下列性质无关的是( )
| A、钠的熔点低 |
| B、钠的密度小 |
| C、钠有强还原性 |
| D、钠的硬度小 |
物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是( )
| A、c (Na+)+c (H+)=c (X-)+c (OH-) |
| B、c (HX)+c (X-)=2 c (Na+) |
| C、若溶液显酸性,则有:c (X-)>c (Na+)>c (HX)>c (H+)>c (OH-) |
| D、若溶液显碱性,则有:c (Na+)>c (HX)>c (X-)>c (OH-)>c (H+) |
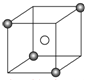 某离子晶体的晶胞结构如图所示,X(
某离子晶体的晶胞结构如图所示,X( )位于立方体的顶点,Y(○)位于立方体的中心.试分析:
)位于立方体的顶点,Y(○)位于立方体的中心.试分析: