题目内容
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应.二者比较,相等的是(溶液体积变化忽略不计)( )
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
| A、①③ | B、②④ | C、③④ | D、只有① |
考点:铜金属及其重要化合物的主要性质,硝酸的化学性质
专题:
分析:铜与浓硝酸反应为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;铜与稀硝酸反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,Cu的质量相同,硝酸足量,则Cu完全反应,结合原子守恒及反应方程式来解答.
解答:
解:①因Cu的质量相同,由于硝酸浓度不同,则反应速率不同,所以反应完所需时间不同,故①错误;
②等物质的量的铜与浓硝酸反应中存在Cu~2NO2,铜与稀硝酸反应中存在3Cu~2NO,反应生成的气体体积不同,故②错误;
③相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应,铜失去电子数相同,所以氧化剂得到的电子数相同,故③正确;
④铜物质的量反应全部反应生成铜离子物质的量相同,溶液体积相同,所以铜离子浓度相同,故④正确;
故选C.
②等物质的量的铜与浓硝酸反应中存在Cu~2NO2,铜与稀硝酸反应中存在3Cu~2NO,反应生成的气体体积不同,故②错误;
③相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应,铜失去电子数相同,所以氧化剂得到的电子数相同,故③正确;
④铜物质的量反应全部反应生成铜离子物质的量相同,溶液体积相同,所以铜离子浓度相同,故④正确;
故选C.
点评:本题考查硝酸的性质,为高频考点,把握发生的反应及反应中物质的量的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意守恒法应用.

练习册系列答案
相关题目
含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示( )
)的废水可以利用微生物电池除去,其原理如图所示( )

 )的废水可以利用微生物电池除去,其原理如图所示( )
)的废水可以利用微生物电池除去,其原理如图所示( )
| A、B极是正极 |
| B、B极是阳极 |
| C、每转移2mol电子,有1molCH3COO-被氧化 |
D、A极电极反应式为: +2e-+H+ +2e-+H+ +Cl- +Cl- |
下列有关物质应用的说法错误的是( )
| A、生石灰用作食品抗氧剂 |
| B、氢氧化铝用于制胃酸中和剂 |
| C、浓氨水可检验氯气管道泄漏 |
| D、氧化铁能用于制作红色涂料 |
以石墨作电极电解下列溶液,电解后加入括号内的物质不能使电解质溶液恢复原状的是( )
| A、CuCl2溶液(CuCl2) |
| B、CuSO4溶液(CuO) |
| C、NaCl溶液(HCl) |
| D、KNO3溶液(KNO3) |
选出下列与浓硫酸的反应活性最高的烯烃( )
A、 |
B、 |
| C、═ |
食盐、纯碱、食醋均为厨房中常用的物质,利用这些物质不能实现的实验是( )
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
①除去热水瓶内壁的水垢
②检验自来水中是否含有氯离子
③检验镁粉中是否含有铝粉
④鉴别食盐和纯碱.
| A、①③ | B、②③ | C、②④ | D、①② |
下列物质中,不能通过化合反应直接生成的是( )
| A、FeS |
| B、Fe(OH)3 |
| C、FeCl2 |
| D、Al(OH)3 |

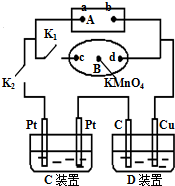 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.