题目内容
某工厂利用CO2和H2合成CH3OH;CO2(g)=3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.
(1)上述反应达到平衡后,升温温度,平衡 (填“正向”“逆向”或“不”)移动.
(2)上述反应的化学平衡常数表达式为K= .一直某温度下该反应的平衡常数K=1.0,某时刻测得该温度下密闭容器中各物质的量浓度如下表:
则此时正反应速率和逆反应速率的关系是 .
(1)上述反应达到平衡后,升温温度,平衡
(2)上述反应的化学平衡常数表达式为K=
| CO? | H? | CH?OH | H?O |
| 0.7mol?L-1 | 0.5mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 |
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)升温,平衡向吸热方向移动;
(2)化学平衡常数等于生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
根据平衡常数与浓度商大小判断平衡移动方向.
(2)化学平衡常数等于生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
根据平衡常数与浓度商大小判断平衡移动方向.
解答:
解:(1)反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应为放热反应,升温,平衡逆向移动,故答案为:逆向;
(2)反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,化学平衡常数表达式为K=
,
某温度下,浓度商为
=
<平衡常数K=1.0,故平衡正向移动,正反应速率大于逆反应速率,
故答案为:
;大于.
(2)反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,化学平衡常数表达式为K=
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
某温度下,浓度商为
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
| 0.3×0.3 |
| 0.7×0.53 |
故答案为:
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
点评:本题考查了化学平衡影响因素分析,平衡常数计算应用,掌握方法和基础知识是关键,题目较简单.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |
下列说法不正确的是( )
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
| C、分子式C4H10表示的物质必是纯净物 |
D、有机物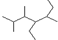 的名称:2,3,5-三甲基-4-乙基庚烷 的名称:2,3,5-三甲基-4-乙基庚烷 |
下列物质中,不能通过化合反应直接生成的是( )
| A、FeS |
| B、Fe(OH)3 |
| C、FeCl2 |
| D、Al(OH)3 |
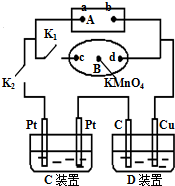 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.