题目内容
18. 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
NaClO过量时,易发生N2H4•H2O+2NaClO═N2↑+2NaCl+3H2O
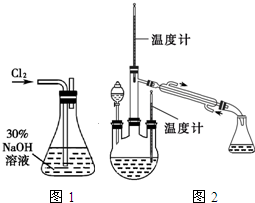
实验一:制备NaClO溶液.(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有BD(填标号);
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的化学方程式是Cl2+2NaOH=NaClO+NaCl+H2O;
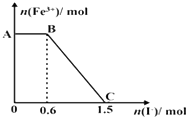
实验二:制取水合肼.(实验装置如图2所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.
(已知:N2H4•H2O+2NaClO═N2↑+3H2O+2NaCl)
(3)分液漏斗中的溶液是A(填标号);
A.CO(NH2)2溶液
B.NaOH和NaClO混合溶液
选择的理由是如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
实验三:测定馏分中肼含量
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol•L-1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右.(已知:N2H4•H2O+2I2═N2↑+4HI+H2O)
(4)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因H++HCO3-=H2O+CO2↑;
(5)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4•H2O)的质量分数为9%.
分析 (1)配制一定质量分数的溶液时,具体步骤是计算、称量、溶解,NaOH固体时需要放在烧杯中称,量取水时需要量筒,溶解时需要烧杯、玻璃棒;
(2)氯气通入到盛有NaOH的锥形瓶中与NaOH发生反应生成氯化钠、次氯酸钠和水;
(3)依据制取水合肼(N2H4•H2O)的反应原理为:CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl,结合反应产物和反应物分析判断;水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(4)NaHCO3能通过与碘化氢的反应控制溶液的pH在6.5左右;
(5)结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数.
解答 解:(1)配制一定质量分数的溶液时,溶解时需要烧杯、玻璃棒,故答案为:BD;
(2)锥形瓶中氯气和NaOH反应生成氯化钠、次氯酸钠和水,故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;
(3)反应CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl中,水合肼(N2H4•H2O)作还原剂,具有还原性,易被次氯酸钠氧化,
故答案为:A;如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化;
(4)NaHCO3能控制溶液的pH在6.5左右,是因为碳酸氢钠和碘化氢反应,反应的离子方程式为H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
(5)结合反应定量关系计算得到馏分中水合肼(N2H4•H2O)的质量分数,
N2H2•H2O+2I2=N2+4HI+H2O
1 2
n 0.1000mol/L×0.018L
n=0.0009mol
250ml溶液中含有的物质的量=0.0009mol×$\frac{250}{25}$=0.009mol
水合肼(N2H2•H2O)的质量分数=$\frac{0.009×50g/mol}{5.00g}$×100%=9.0%,
故答案为:9%.
点评 本题考查了物质制备和性质的实验分析和验证方法应用,主要是过程分析判断,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:下列叙述错误的是( )
| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
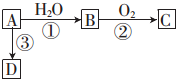
| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
| A. | Cu和Na | B. | Fe和Cu | C. | Cu与Al | D. | Al与Na |
| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
 已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.
已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.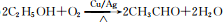 .
. .
. ;
;