题目内容
10.下列有关说法正确的是( )| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
分析 A.醋酸为弱电解质,等pH时,醋酸浓度大;
B.根据电荷守恒分析;
C.$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,则c(H+)=10-1mol/L;
D.NaOH的浓度为10-3mol/L,若HA为弱酸,则酸的浓度大于10-3mol/L.
解答 解:A.醋酸为弱电解质,等pH时,醋酸浓度大,反应速率大,用时少,故A错误;
B.氨水与(NH4)2SO4的混合溶液pH=7时,溶液中的电荷守恒为c(NH4+)+c(H+)=2c(SO42-)+c(OH-),溶液显中性,则c(H+)=c(OH-)所以c(NH4+)与c(SO42-) 之比为2:1,故B正确;
C.$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,则c(H+)=10-1mol/L,酸的浓度与氢离子浓度相同,说明HA为强酸,所以在HA的溶液中加入一定量NaA晶体,溶液中c(OH-)不变,故C错误;
D.NaOH的浓度为10-3mol/L,若HA为弱酸,则酸的浓度大于10-3mol/L,若混合液显中性,则需要多加氢氧化钠,所以V1≥V2,故D错误.
故选B.
点评 本题综合考查弱电解质的电离以及平衡移动的影响因素、电荷守恒的应用等,注意弱酸溶液在稀释时溶液中离子浓度的变化,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
20.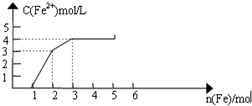 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示.则原溶液中Fe3+与NO3-物质的量浓度之比为( )| A. | 1:8 | B. | 1:9 | C. | 3:8 | D. | 1:11 |
1.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图:
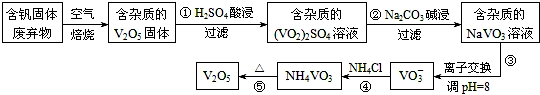
部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
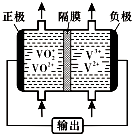
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
5.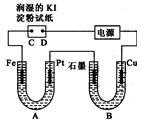 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
15.下列说法正确的是( )
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |
2.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B中的长颈漏斗的作用是平衡压强
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+□
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
(4)完成对所得产品的检测的实验:

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B中的长颈漏斗的作用是平衡压强
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+□
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
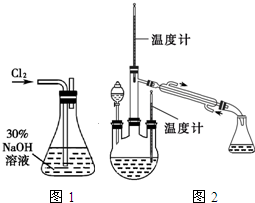 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).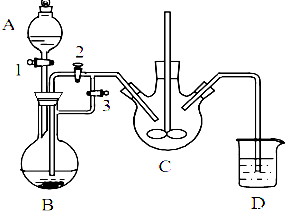 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: