题目内容
7.白磷(P4)在氯气中燃烧有白色的烟雾生成,其产物为PCl3和PCl5的混合物,试回答下列问题.(1)P元素基态原子3P能级上电子排布图为
 ;
;(2)P4分子的空间结构是正四面体形,每个分子中含6个σ键,键角为60○;
(3)PCl3分子中P原子的杂化类型为sp3;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198nm和206nm两种,这两种离子的化学式为PCl4+和PCl6-;
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因PBr5═PBr4++Br-.
分析 (1)P元素基态原子电子排布为1s22s22p63s23P3,所以3P能级上电子排布图为 ;
;
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,形成6个P-P单键,所以键角为60°;
(3)根据价层电子对互斥理论确定分子或离子中中心原子的价层电子对数,再判断杂化类型;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;
(5)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-.
解答 解:(1)P元素基态原子电子排布为1s22s22p63s23P3,所以3P能级上电子排布图为 ,故答案为:
,故答案为: ;
;
(2)在白磷分子(P4)中,P原子在由4个P原子构成的正四面体上,形成6个P-P单键,所以每个分子中含6个σ键,键角为60°,故答案为:6;60○;
(3)PCl3分子中P的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,属于sp3杂化,故答案为:sp3;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,故答案为:PCl4+和PCl6-;
(5)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-,故答案为:PBr5═PBr4++Br-.
点评 本题考查物质结构和性质,涉及电子排布图、杂化方式的判断、电离方式和微粒结构等,侧重于基础知识的综合应用的考查,题目难度中等.

| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(2)NaAlO 2溶液呈碱性的原因是AlO2-+2H2O?Al(OH)3+OH-(用离子方程式表示).将溶液加热蒸干最后得到的固体产物是NaAlO2;
(3)结合表中数据分析,与0.1mol/L的CH 3COONa溶液中水的电离程度相同的有BE(填字母代号).
A.pH=8.8的NaOH溶液 B.pH=5.2的NH 4Cl溶液 C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液 E.pH=8.8的Na 2CO 3溶液
(4)将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度关系正确的有BDE.
A.c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
F.c(Na+)>c(CO32-)>c(HCO3-)>c(H+)>c(OH-)
(5)0.2mol/LHCl与0.1mol/L NaAlO 2溶液等体积混合溶液后离子浓度顺序为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-).
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B中的长颈漏斗的作用是平衡压强
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+□
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
| A. | M只能是碱类 | B. | M只能是盐类 | C. | M一定为电解质 | D. | M可能为非电解质 |
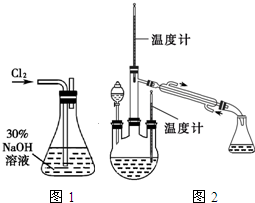 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
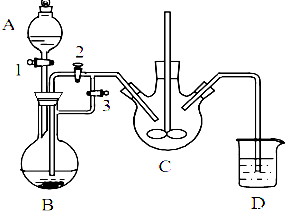 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: