题目内容
8.已知0.1mol•L-1的醋酸溶液中存在电离平衡:CH3COOH???CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,可以采取的措施是( )①加水 ②升高温度 ③加少量冰醋酸④加少量烧碱固体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,应是平衡向电离的方向移动,结合影响平衡移动的因素解答该题.
解答 解:①加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡:CH3COOH?CH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的大,所以比值增大,故①正确;
②升高温度,弱电解质的电离为吸热过程,加热促进电离,则比值增大,故②正确;
③加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故③错误;
④加少量烧碱固体,CH3COOH???CH3COO-+H+,平衡正向移动,反应生成CH3COO-,CH3COO-浓度增大,$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(C{H}_{3}CO{O}^{-})}$=$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$,所以比值减小,故④错误;
故选A.
点评 本题考查弱电解质的电离,侧重于考查学生的分析能力和化学基本概念的理解和应用能力,为高考常见题型,难度中等,注意把握影响弱电解质的电离的影响因素.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
13.用纯碱固体配制一定物质的量浓度的该溶液时,不需要使用的玻璃仪器是( )
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 容量瓶 | D. | 圆底烧瓶 |
17.有一种固体化合物M,M本身不导电,但熔融状态或溶于水均能够电离,下列关于M的说法中,正确的是( )
| A. | M只能是碱类 | B. | M只能是盐类 | C. | M一定为电解质 | D. | M可能为非电解质 |
18.下列叙述正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
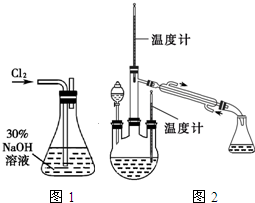 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).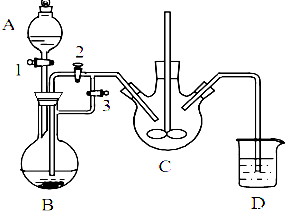 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).