题目内容
13.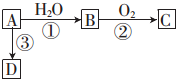 已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.
已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.请回答下列问题:
(1)写出A 的结构简式:CH2=CH2.
(2)反应①的反应类型为加成反应.
(3)B→C的转化,通常需铜或银作催化剂,写出转化的化学方程式:
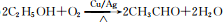 .
.(4)D是一种聚合物,常用于塑料产品,其结构简式为
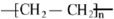 .
.
分析 A是一种相对分子质量为28的气态烃,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应生成C为CH3CHO,D是一种聚合物,常用于塑料产品,则CH2=CH2发生加聚反应生成高聚物D为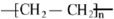 ,据此解答.
,据此解答.
解答 解:A是一种相对分子质量为28的气态烃,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生氧化反应生成C为CH3CHO,D是一种聚合物,常用于塑料产品,则CH2=CH2发生加聚反应生成高聚物D为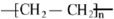 ,
,
(1)根据上面的分析可知,A为CH2=CH2,
故答案为:CH2=CH2;
(2)反应①为乙烯与水的加成,所以反应类型为加成反应,
故答案为:加成反应;
(3)B→C是乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,反应方程式为: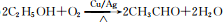 ,
,
故答案为: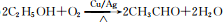 ;
;
(3)乙醇别直接氧化为乙酸,需要加入的试剂是:酸性高锰酸钾溶液等,故答案为:酸性高锰酸钾溶液;
(4)根据上面的分析可知,D为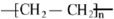 ,故答案为:
,故答案为: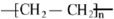 .
.
点评 本题考查有机物推断,涉及烯与醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
3.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
4.下列关于钠的叙述正确的是( )
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
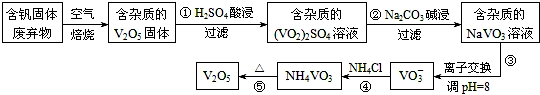
1.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图:
部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
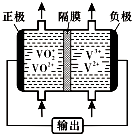
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
8.用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是( 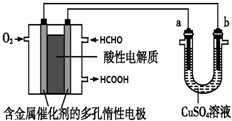

| A. | 当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑ | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4 OH- | |
| C. | 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- | |
| D. | 燃料电池工作时,负极反应为:HCHO+H2O-2e-═HCOOH+2H+ |
5.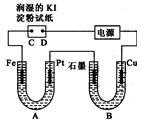 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
2.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:实验制备装置如图所示(省略夹持装置):

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B中的长颈漏斗的作用是平衡压强
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+□
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
(4)完成对所得产品的检测的实验:

回答问题:
(1)仪器a的名称是分液漏斗.
(2)装置B中的长颈漏斗的作用是平衡压强
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+□
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
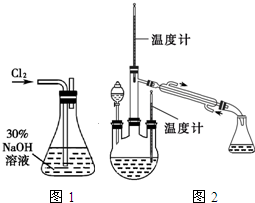 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O). 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).