题目内容
5.2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现.某反应在Pd/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示,(图中HC表示碳氢化合物,nitrate指硝酸盐)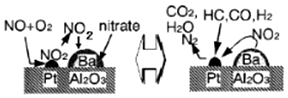
下列说法不正确的是( )
| A. | 该机理研究的是汽车尾气催化转化机理 | |
| B. | CO在催化剂表面被还原生成CO2,铂起催化作用 | |
| C. | CO在催化剂表面可能和O2、NO反应 | |
| D. | NO、CO均能与人体中的血红蛋白结合 |
分析 A.依据机理图结合催化剂表面的气体吸收与放出来分析判断;
B.铂起催化作用,CO在催化剂表面被氧化生成CO2;
C.CO能被O2、NOx氧化;
D.NO、CO均能与人体中的血红蛋白结合而使人中毒.
解答 解:A.在机理图中根据气体的吸附与解吸可知,氮氧化物、一氧化碳等污染气体在催化剂表面转化为无毒气体二氧化碳和氮气,属于汽车尾气的催化转化机理,故A正确;
B.在该反应中铂是催化剂,起催化作用,CO在催化剂表面生成CO2,C(+2→+4),碳元素化合价升高被氧化,故B错误;
C.CO能被O2、NOx氧化,所以CO在铂表面可能和O2、NOx反应,生成CO2和N2,故C正确;
D.CO、NO是有毒的气体,能与人体中的血红蛋白结合,使人缺氧中毒,故D正确;
故选B.
点评 本题主要考查汽车尾气的成分、生成、催化净化原理和反应条件应用,要多关注与化学知识相关系的生产、生活中的热点问题,做到学以致用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊不消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊;再加入品红溶液,溶液为红色 | Ca(ClO)2溶液 |
| D | 通入SO2,溶液没有明显变化;再通入氨气,溶液变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.已知A+.B2+.C-.D2-为同周期主族元素的离子,则下列叙述正确的是( )
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
13.图1是电解饱和氯化钠溶液示意图.图2中,x轴表示实验时流入阴极的电子的物质的量,y轴表示( )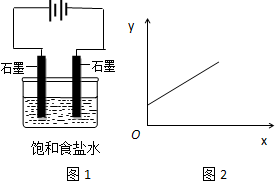

| A. | n(Na+) | B. | n(Cl-) | C. | c(OH-) | D. | c(H+) |
20.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
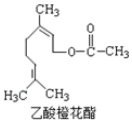

| A. | 分子式为 C12H22O2 | |
| B. | 1mol 该有机物水解时只能消耗 1 mol NaOH | |
| C. | 能使酸性 KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| D. | 1mol 该有机物在一定条件下和 H2反应,共消耗 H2 为 3mol |
10.下列仪器及其名称不正确的是( )
| A. |  量筒 | B. |  试管 | C. |  坩埚 | D. |  试剂瓶 |
17.某化学反应 3A?2B+D在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内用D的浓度变化表示的平均速率为0.01mol/(L•min).
(2)在实验 2,A 的初始浓度 c2为2.0mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且c3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是升高温度平衡向逆向移动,所以正反应是放热反应.
15.一定温度下,反应2NO2(g)?N2O4(g)△H<0,在密闭容器中达到平衡状态. 下列说法中正确的是( )
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |