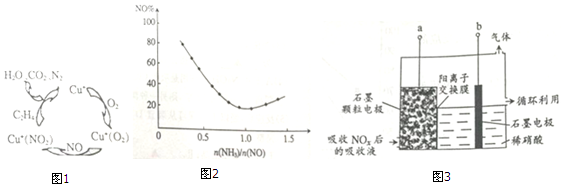
题目内容
3.向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,随n(CO2)增大,先后发生三个反应.已知酸性:H2CO3>HCO3->Al(OH)3.下列说法正确的是( )| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
分析 向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,n(NaAlO2)=0.1mol,n(NaOH)=0.2mol,先后发生三个反应,已知酸性:H2CO3>HCO3->Al(OH)3 ,形成盐的水解程度HCO3-<CO32-<AlO2-,反应顺序为:CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,Na2CO3+CO2+H2O=2NaHCO3,
A.n(CO2)=0.1时,反应的反应为CO2+2NaOH=Na2CO3+H2O,溶液中溶质为0.1mol碳酸钠、0.1molNaAlO2,水解程度HCO3-<CO32-<AlO2-,分析判断离子浓度大小;
B.0.1mol<n(CO2)<0.15时发生的反应是CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3;
C.n(CO2)=0.15时发生的反应是CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,溶液中溶质为Na2CO3;
D.n(CO2)=0.3时发生反应CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,Na2CO3+CO2+H2O=2NaHCO3,溶液中为NaHCO3.
解答 解:向1L含0.1mol/LNaAlO2和0.2mol/LNaOH的溶液中缓缓通入二氧化碳,n(NaAlO2)=0.1mol,n(NaOH)=0.2mol,先后发生三个反应,已知酸性:H2CO3>HCO3->Al(OH)3 ,形成盐的水解程度HCO3-<CO32-<AlO2-,反应顺序为:CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,Na2CO3+CO2+H2O=2NaHCO3,
A.n(CO2)=0.1时,反应的反应为CO2+2NaOH=Na2CO3+H2O,溶液中溶质为0.1mol碳酸钠、0.1molNaAlO2,水解程度HCO3-<CO32-<AlO2-,溶液中离子浓度大小c(AlO2-)<c(CO32-),故A错误;
B.0.1mol<n(CO2)<0.15时发生的反应是CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,未发生Na2CO3+CO2+H2O═2NaHCO3,故B错误;
C.n(CO2)=0.15时发生的反应是CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,溶液中溶质为Na2CO3,c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故C错误;
D.n(CO2)=0.3时发生反应CO2+2NaOH=Na2CO3+H2O,CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3,Na2CO3+CO2+H2O=2NaHCO3,溶液中为NaHCO3,溶液中碳酸氢根离子水解大于电离,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故D正确;
故选D.
点评 本题考查了物质反应产物的定量计算判断,电解质溶液中离子浓度大小比较,主要是化学方程式计算和产物的分析判断,掌握基础是解题关键,题目难度中等.

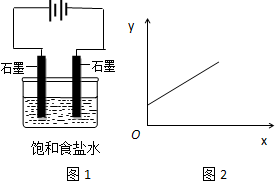
| A. | n(Na+) | B. | n(Cl-) | C. | c(OH-) | D. | c(H+) |
| A. | 常温下电离常数为Ka的酸HA 溶液中 c (H+)=$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) | |
| C. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合2c(H+)-2c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
| A. | 铁与盐酸的反应:2Fe+6H +═2Fe 3 ++3 H 2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO 3+2H +═Ca 2 ++2H 2O+CO 2↑ | |
| C. | 铜片插入硝酸银溶液:Cu+Ag +═Cu 2++Ag | |
| D. | 钠与水反应::2Na+2H 2O═2OH -+2Na ++H 2↑ |
| A. | 烷烃能使酸性高锰酸钾溶液褪色 | B. | 苯环能使酸性高锰酸钾溶液褪色 | ||
| C. | 甲基使苯环的活性增强 | D. | 苯环使甲基的活性增强 |
| A. | 恒温缩小体积,平衡向右移动,再次达平衡时颜色比原平衡浅 | |
| B. | 恒容升温,逆反应速率加快,正反应速率减慢 | |
| C. | 若改变条件使平衡向右移动,则该反应的平衡常数将增大 | |
| D. | 恒温恒容,充入少量NO2,再次达平衡时NO2的转化率比原平衡的大 |
 短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.
短周期主族元素W、X、Y、Z的原子序数依次增加.K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体.K是无色气体,是主要的大气污染物之一.0.05mol/L丙溶液的pH为1,上述物质的转化关系如图所示.下列说法正确的是( )
| A. | 丙也可由W、Y组成的某种化合物与K直接反应制得 | |
| B. | K、L、M 中沸点最高的是M | |
| C. | 原子半径:W<X<Y | |
| D. | 元素的非金属性:Z>Y>X |
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |