题目内容
12.下列实验操作能达到相应实验目的是( )| 选项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入稀盐酸 | 比较Fe和Cu的金属活动性 |
| D | 将两根铁钉分别放入甲乙两支试管中,甲为干燥的试管,乙中含有少量食盐水. | 证明有NaCl参加反应,腐蚀速率更快 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯含碳碳双键,能被高锰酸钾氧化;
B.氯气与NaOH反应,碱性降低;
C.金属性越强,与酸反应越剧烈;
D.乙中含有少量食盐水,发生电化学腐蚀.
解答 解:A.乙烯含碳碳双键,能被高锰酸钾氧化,溶液褪色,为氧化反应,故A错误;
B.氯气与NaOH反应,碱性降低,则溶液由红色变化为无色,不能说明氯气具有漂白性,且氯气不具有漂白性,故B错误;
C.金属性越强,与酸反应越剧烈,则该实验可比较Fe和Cu的金属活动性,故C正确;
D.乙中含有少量食盐水,发生电化学腐蚀,但NaCl不参加反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
17.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之.”文中涉及的操作方法是( )
| A. | 蒸馏 | B. | 升华 | C. | 干馏 | D. | 萃取 |
7.以下关于元素性质的比较正确的是( )
| A. | 稳定性:NH3>H2O>HF | B. | 离子半径:Na+<Mg2+<Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 金属还原性:Mg>Ca |
17.下列有关实验仪器的使用及实验操作正确的是( )
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
4.氯水是化学实验室中常用的一种试剂,下列有关该试剂的说法错误的是( )
| A. | 氯水显酸性的主要原因:HClO?H++ClO- | |
| B. | 向氯水中滴加少量NaHCO3溶液:H++HCO3-═CO2↑+H2O | |
| C. | SO2具有漂白性,向氯水中通入少量SO2,溶液的漂白能力降低 | |
| D. | 常温时,氯水中含有的阴离子:Cl-、ClO-、OH- |
7.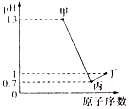 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | Y、Z的简单离子都会影响水的电离平衡 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | X、Y分别与W形成的化合物皆为离子化合物 |
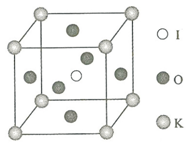 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题: