题目内容
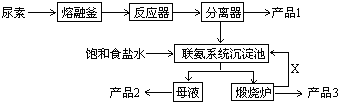
2.碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用.(1)工业碳酸钠(纯度约为98%)中含有Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
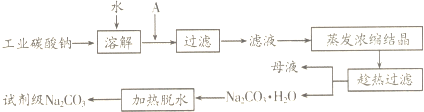
碳酸钠的饱和溶液在不同温度下析出的溶质如图所示
请回答下列问题:
①试剂A是氢氧化钠溶液,“母液”中除了含有Na+、CO32-、OH-离子外,还含有Cl-、SO42-等离子,过滤要“趁热”的目的是提高Na2CO3•H2O含量.
②检验试剂Na2CO3中Cl-和SO42-是否除尽,选用的试剂及加入的先后次序是c(填序号).
a.HCl、BaCl2、AgNO3 b.AgNO3、HNO3、Ba(NO3)2
c.HNO3、Ba(NO3)2、AgNO3 d.AgNO3、HCl、BaCl2
(2)“侯氏制碱法”的原理:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl
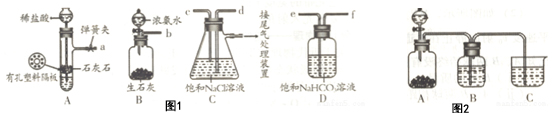
图1是某兴趣小组在实验室中模拟“侯氏制碱法”制取NaHCO3所用到的主要装置.
请回答下列问题:
①各仪器口的链接顺序为a接e、f接d,b接c,实验时先向饱和NaCl溶液中通入较多的NH3,再通入足量的CO2,其原因是a(填写序号字母).
a.使CO2更易被吸收 b.NH3比CO2更易制取 c.CO2的密度比NH3大
②该兴趣小组用图2比较C、N、Si三种元素的非金属性强弱,B中的试剂是饱和碳酸氢钠溶液,能说明碳的非金属性比硅强的实验现象是c中生成白色胶状物质.(H2SiO3是一种不溶于水的白色胶状物);
指出该实验不严谨之处c装置中的Na2SiO3溶液吸收空气中的CO2等酸性气体生成白色沉淀干扰实验结果.
分析 (1)①工业碳酸钠中含有Mg2+,Fe3+,所以“除杂”中加入过量的NaOH溶液,除去溶液中的Mg2+,Fe3+,滤液中除了含有 Na+、CO32-、OH-离子外,还含有Cl-、SO42-;依据碳酸钠的饱和溶液在不同温度下析出的溶质解答过滤要“趁热”的目的;
②a.HCl、BaCl2、AgNO3,此顺序中,氯离子会干扰是否除净的实验;
b.AgNO3、HNO3、Ba(NO3)2,此顺序中先加入硝酸银碳酸根离子、氯离子、硫酸根离子都会沉淀,无法检验硫酸根离子是否除净;
c.HNO3、Ba(NO3)2、AgNO3,显加入硝酸和碳酸钠反应,再加入硝酸钡检验是否含有硫酸根离子,最后用硝酸银溶液检验是否含有氯离子;
d.AgNO3、HCl、BaCl2,此顺序中先加入硝酸银碳酸根离子、氯离子、硫酸根离子都会沉淀,加入盐酸后氯离子无法检出;
(2)①A为制取二氧化碳装置,B为制取氨气的装置,C为氨气、二氧化碳、氯化钠溶液反应装置,D为洗气装置,除去二氧化碳中的氯化氢,要完成实验应分别制取洁净二氧化碳、氨气,据此排序;依据二氧化碳、氨气在水中的溶解性判断通入的先后顺序;
②比较C、N、Si三种元素的非金属性强弱,可以利用其最高价含氧酸的酸性强弱比较,硝酸制取碳酸,碳酸制取硅酸,据此判断B中试剂;
c漏置于空气中,空气中的二氧化碳等酸性气体能够与硅酸钠反应生成硅酸沉淀,对实验造成干扰;
解答 解:(1)①因工业碳酸钠中含有Mg2+,Fe3+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3;除去g2+,Fe3+,滤液中除了含有 Na+、CO32-、OH-离子外,还含有Cl-、SO42-;依据流程图可知过滤得到产品为Na2CO3•H2O和母液,而从碳酸钠的饱和溶液在不同温度下析出的溶质可知温度较高时析出物质为Na2CO3•H2O,所以过滤要“趁热”的目的是 提高Na2CO3•H2O含量,
故答案为:氢氧化钠溶液;Cl-、SO42-;高Na2CO3•H2O含量;
②a.按照此顺序加入试剂HCl、BaCl2、AgNO3,氯离子会干扰是否除净的实验,故a错误;
b.按照此顺序加入试剂AgNO3、HNO3、Ba(NO3)2,顺序中先加入硝酸银碳酸根离子、氯离子、硫酸根离子都会沉淀,无法检验硫酸根离子是否除净,故b错误;
c.按照此顺序加入试剂HNO3、Ba(NO3)2、AgNO3,先加入硝酸和碳酸钠反应,再加入硝酸钡检验是否含有硫酸根离子,最后用硝酸银溶液检验是否含有氯离子,故c正确;
d.按照此顺序加入试剂AgNO3、HCl、BaCl2,顺序中先加入硝酸银碳酸根离子、氯离子、硫酸根离子都会沉淀,加入盐酸后氯离子无法检出,故d错误;
故选:c;
(2)①由于CO2在水中的溶解度小,而氨气极易溶于水,因此先通入氨气,然后再通入CO2,由于氨气极易溶于水需要防止倒吸,因此c通入NH3,d通入CO2,装置A制备的二氧化碳气体中含有氯化氢气体,需要通过饱和碳酸氢钠溶液除去,装置仪器接口的连接顺序为:aefd,cb,
先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,故选a,
故答案为:efdc,a;
②酸性强的可以制备反应生成酸性弱的,装置中的试剂分别为:分液漏斗中为硝酸,A中为大理石,硝酸和碳酸钙反应生成二氧化碳,硝酸酸性大于碳酸,为避免挥发出硝酸干扰,二氧化碳通过饱和碳酸氢钠溶液除去硝酸蒸气,能说明碳的非金属性比硅强的实验现象是,得到二氧化碳气体通入烧杯中的硅酸钠溶液,生成硅酸白色胶状沉淀,证明碳酸酸性大于硅酸;c漏置于空气中,空气中的二氧化碳等酸性气体能够与硅酸钠反应生成硅酸沉淀,对实验造成干扰,
故答案为:饱和碳酸氢钠溶液,C中出现白色胶状沉淀;c装置中的Na2SiO3溶液吸收空气中的CO2等酸性气体生成白色沉淀干扰实验结果.
点评 本题考查了物质的分离提纯,物质制备实验流程分析判断,物质性质的理解应用,掌握实验基本操作和物质的制备原理和检验方法是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 还原剂中必定有元素化合价升高被氧化 | |
| B. | 通电后,氢氧化铁胶体向阴极运动 | |
| C. | 物质所含元素化合价升高的反应叫还原反应 | |
| D. | 胶体与其他分散系的本质区别是可以发生丁达尔效应 |

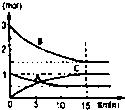 在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.
在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g)?pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图.