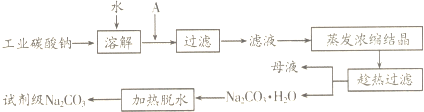
题目内容
13.(1)氨气的摩尔质量是17g/mol.3.4g氨气的物质的量是0.2mol,所含分子数为0.2NA,在标准状况下的体积为4.48L,溶于水配成200mL的溶液时,其物质的量浓度为1mol/L.(2)合理利用化学反应可以造福人类.
①生产消毒液是将氯气通入NaOH 溶液中,发生的离子反应方程式为:Cl2+2OH-═ClO-+Cl-+H2O;
②过氧化钠可用于呼吸面具或潜水艇中作为氧气来源,写出相应的化学反应方程式2Na2O2+2CO2═2Na2CO3+O2;
③家庭生活中漂白粉漂白原理,写出相应化学方程式Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
分析 (1)根据氨气的相对分子质量判断其摩尔质量;根据n=$\frac{m}{M}$计算出氨气的物质的量,根据N=nNA计算出含有分子数,根据V=nVm计算出标准状况下该氨气的体积,根据c=$\frac{n}{V}$计算出所得溶液的浓度;
(2)①氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气;
③次氯酸钙可以和空气中的水及二氧化碳反应生成具有漂白作用的次氯酸.
解答 解:(1)氨气的相对分子质量为17,其摩尔质量为17g/mol;3.4g氨气的物质的量为:$\frac{3.4g}{17g/mol}$=0.2mol,含有氨气分子数为0.2NA;标准状况下0.2mol氨气的物质的量为:22.4L/mol×0.2mol=4.48L;所得溶液浓度为:$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:17g/mol;0.2mol;0.2NA;4.48L;1mol/L;
(2)①二者反应生成氯化钠、次氯酸钠、水,反应的离子反应为:Cl2+2OH-═ClO-+Cl-+H2O,
故答案为:Cl2+2OH-═ClO-+Cl-+H2O;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
③家庭生活中漂白粉的漂白原理为:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查较为综合,涉及离子方程式、化学方程式书写及物质的量的计算,题目难度中等,明确书写原则为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等之间的关系,试题培养了学生的灵活应用能力.

 口算题天天练系列答案
口算题天天练系列答案| A. | 5.0 mol/L | B. | 0.50 mol/L | C. | 1.0 mol/L | D. | 0.10 mol/L |
| A. | 电解AlCl3饱和溶液,可制得金属铝 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
| A. | 为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 | |
| B. | 原电池工作时,电流的方向由正极→负载→负极→原电池中电解质溶液→正极 | |
| C. | 纯银在空气中久置变黑发生的是化学腐蚀 | |
| D. | 在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
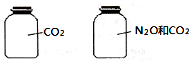 如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )
如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不一定正确的是( )| A. | 所含氧原子数相等 | B. | 气体的总质量相等 | ||
| C. | 气体所含电子总数相等 | D. | 气体的密度相等 |
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入盐酸溶液中:2Fe+6H+═Fe3++3H2↑ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |