题目内容
14.氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质.为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作.下列说法正确的是( )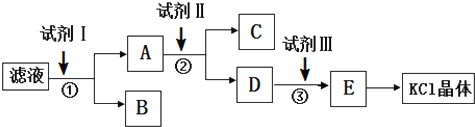
| A. | 起始滤液的pH=7 | |
| B. | 步骤②中加入试剂 II的目的是除去CO32- | |
| C. | 试剂 I为Ba(NO3)2溶液 | |
| D. | 试剂Ⅲ为稀盐酸 |
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液;为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,由实验流程可知,滤液中加试剂I为过量BaCl2,然后过滤后,B含碳酸钡、硫酸钡,A中含氯化钡、氯化钾,再加试剂Ⅱ为过量K2CO3,过滤后C中为碳酸钡,然后过滤,D中含碳酸钾、KCl,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到KCl晶体,以此来解答.
解答 解:由实验流程可知,滤液中加试剂I为过量BaCl2,然后过滤后,B含碳酸钡、硫酸钡,A中含氯化钡、氯化钾,再加试剂Ⅱ为过量K2CO3,过滤后C中为碳酸钡,然后过滤,D中含碳酸钾、KCl,再加入试剂Ⅲ为过量盐酸,除去过量的碳酸钾,最后通过加热浓缩、蒸发结晶得到KCl晶体,
A.含碳酸钾水解显碱性,则起始滤液的pH>7,故A错误;
B.②中加入试剂 II的目的是除去钡离子,故B错误;
C.试剂I为BaCl2,故C错误;
D.由上述分析可知试剂Ⅲ为稀盐酸,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验相结合的训练,注意除杂试剂要过量及试剂的加入顺序,题目难度不大.

练习册系列答案
相关题目
2.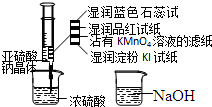 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素 | |
| B. | 沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性 | |
| C. | 实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染 | |
| D. | 蓝色石蕊试纸变红说明SO2溶于水显酸性 |
9.下列各组物质性质的比较中正确的是( )
| A. | CH4、CCl4、C60都是含有极性键的非极性分子 | |
| B. | 非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 | |
| C. | 弱电解质水溶液导电能力不一定比强电解质水溶液导电能力弱 | |
| D. | 空间利用率:简单立方堆积<体心立方堆积<六方最密堆积<面心立方最密堆积 |
19.若阿伏加德罗常数的值为NA,则下列说法中正确的是( )
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
6.下列属于氧化还原反应的是( )
| A. | 钠与水反应 | B. | FeCl3与NaOH溶液反应 | ||
| C. | Al(OH)3与盐酸反应 | D. | NaHCO3受热分解 |

 .
.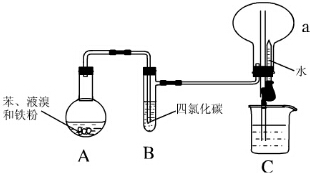 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.