题目内容
15.下列指定微粒的数目不相等的是( )| A. | 等物质的量的水与重水含有的电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的原子数 | |
| D. | 常温下等物质的量的铝分别与足量氯气、浓硝酸反应时转移的电子数 |
分析 A.H和D原子的中子数不同,电子数相同;
B.乙烯有6对共用电子对,丙烯有9对;
C.同温、同压、同体积,由n=$\frac{V}{{V}_{m}}$可知,气体的物质的量相同;
D.常温下铝和浓硝酸发生钝化反应,反应很快停止,不能完全进行.
解答 解:A.H和D原子的中子数不同,物质的量相等的H2O与D2O含有的中子数比值为(8):(8+2×1)=8:10,中子数不同,电子数相等,1mol都为10mol电子,故A错误;
B.1 个乙烯中共用电子对数为 6,1 个丙烯中共用电子对数为 9,等质量的乙烯和丙烯共用电子对数比为:$\frac{m}{28}$×6:$\frac{m}{42}$×9=1:1,等质量的乙烯和丙烯中含有共用电子对数相同,故B错误;
C.同温、同压、同体积,由n=$\frac{V}{{V}_{m}}$可知,气体的物质的量相同,CO和NO都为双原子分子,所以两者含有的原子数相同,故C错误;
D.铝与足量氯气完全反应,Al元素的化合价由0升高为+3价,但常温下铝和浓硝酸发生钝化反应,在铝表面形成致密的氧化膜,阻止反应进一步发生,无法计算其转移的电子数,所以两反应反应时转移的电子数不相等,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成、物质的量计算公式、转移电子计算等为解答的关键,侧重分析与应用能力、计算能力的考查,题目难度不大.

练习册系列答案
相关题目
3.氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注.
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
(1)实验①和②的目的是探究浓度对反应速率的影响.
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 加入物质 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 9mL 5% H2O2溶液 | 1mL 水 |
| ④ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 HCl溶液 |
| ⑤ | 9mL 5% H2O2溶液 | 1mL 0.1mol•L-1 NaOH溶液 |
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1所示.

分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用.为探究不同浓度的Fe3+对H2O2分解的催化效果,实验小组的同学设计了如图2所示的实验装置进行实验.
限选试剂:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水
(3)某同学通过测定O2的体积来比较H2O2的分解速率快慢.实验时可以通过测量相同时间内产生O2的体积(产生相同体积氧气所需的时间)来比较.(要求所测得的数据能直接体现反应速率大小).
(4)参照如表格式,拟定实验表格,完整体现上述实验的方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 实验序号 | V[30% H2O2]/mL | … | |
| 1 | a | … | |
| 2 | a | … |
10.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu/Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有:升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积.
20.下列说法正确的是( )
| A. | 离子化合物中一定含有金属阳离子 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 在酸碱盐中,碱与盐一定属于离子化合物 | |
| D. | 离子化合物中一定存在离子键 |
7.分子式为 C4H10O 并能与金属钠反应放出氢气的有机物有(不含立体异构)( )
| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
4.有关如图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,正确的是( )
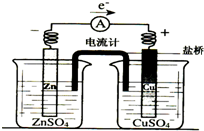

| A. | 铜片上有气泡逸出 | |
| B. | 取出盐桥后,电流计依然发生偏转 | |
| C. | 反应中,盐桥中的K+会移向CuSO4溶液 | |
| D. | 铜片上发生氧化反应 |
5.如果慢慢把下列溶液加热蒸干并灼烧,可以得到该溶液溶质固体的是( )
| A. | 高锰酸钾 | B. | 亚硫酸钠 | C. | 氯化铁 | D. | 碳酸钾 |
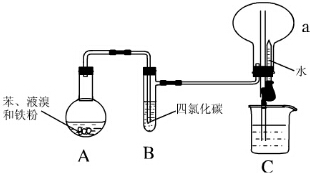 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.