题目内容
17.工业上冶炼下列金属,必须另加还原剂的是( )| A. | Al | B. | Fe | C. | Cu | D. | Ag |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法.
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得,
物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.铝性质活泼,用电解熔融的氧化铝的方法冶炼,不需要还原剂,故A错误;
B.铁性质较活泼,用热还原法冶炼,必须另加还原剂,故B正确;
C.铜性质较不活泼,用热还原法冶炼,必须另加还原剂,故C正确;
D.银性质不活泼,用热分解法冶炼,故D错误;
故选BC.
点评 本题考查了金属的冶炼方法,熟悉金属活泼性与常用的冶炼方法是解题关键,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
8.设NA表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 将1molNH4NO3于稀氨水便溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4L甲烷中含有的C-H键数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中含有H+的数目为0.01NA | |
| D. | 1molFe与1molCl2充分反应转移电子数为3NA |
8.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 油脂、纤维素和蛋白质均能发生水解,且最终水解产物均不相同 | |
| B. | 酒精浓度过高或过低都不利于杀菌消毒,医用酒精中乙醇的质量分数为75% | |
| C. | 鸡蛋清和淀粉溶液都属于胶体,遇到硫酸铜溶液可以发生胶体聚沉 | |
| D. | 纤维素可以加强肠胃蠕动,有助于消化,因此纤维素是人体的营养物质 |
5.下表是25℃时三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.
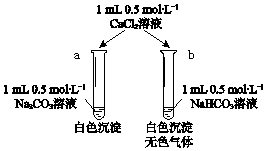
①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-.
(2)NaHCO3的电离方程式是NaHCO3=Na++HCO3-.
(3)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为CO32->A->HCO3->NO2-.
(4)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(H+),解释HA和NaA的混合溶液呈碱性的原因A-离子水解程度大于HA电离程度.
(5)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-.
(6)某同学用Na2CO3和NaHCO3溶液进行如图所示实验.

①充分反应后a试管中大量存在的离子是Na+、Cl-.
②用离子方程式表示b试管中发生的反应2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
4.下列过程中吸收热量的是( )
| A. | 甲烷的燃烧 | B. | 浓硫酸的稀释 | ||
| C. | NH4Cl与Ba(OH)2•8H2O反应 | D. | 铝热反应 |
11.烷烃 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有( )| A. | 8种 | B. | 6种 | C. | 2种 | D. | 1种 |
8.设阿伏加德罗常数为NA,下列说法中正确的是(Mg-24 H-1 O-16)( )
| A. | 18g H2O含有的电子数8NA | |
| B. | 常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA | |
| C. | 常温常压下,22.4L的氧气中含氧原子数为2NA | |
| D. | 2.4g的Mg粉与足量的盐酸反应失去电子数为0.2NA |
13.下列实验不能达到预期目的是( )
| A. |  探究乙烯与Br2的加成反应 | B. |  探究苯分子是否含有碳碳双键 | ||
| C. |  探究乙醇的还原性 | D. |  制取少量乙酸乙酯 |
