题目内容
12.碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③过滤,步骤⑤萃取分液.
(2)写出步骤④对应反应的离子方程式:Cl2+2I-═I2+2Cl-.
(3)步骤④除了加入过量Cl2,下列氧化剂最好选用B(填代号).
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
(4)提取碘的过程中,可供选择的有机试剂是CD.(填编号)
A.酒精 B.醋酸 C.四氯化碳 D.苯.
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,以此解答该题,
(1)步骤③是分离固体和溶液,用过滤;步骤⑤是从水溶液提取碘单质;
(2)氯气具有强氧化性,能将碘离子氧化为碘;
(3)过氧化氢是绿色氧化剂,在氧化过程中不会引进杂质、不产生污染;
(4)萃取剂的选取标准:萃取剂和溶质不反应,萃取剂和原溶剂不互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度.
解答 解:海藻在坩埚中灼烧得到海藻灰,将海藻灰浸泡得到海藻灰悬浊液,然后利用过滤的方法分离海藻灰悬浊液,得到残渣和溶液,在溶液中通入过量氯气,氯气和碘离子发生氧化还原反应得失I2,向含有I2的溶液中加入有机溶剂进行萃取,得到含有碘的有机溶液,再利用蒸馏的方法得到晶态碘,
(1)分离不溶性固体和溶液采用过滤方法,分离碘水中的碘采用萃取的方法,所以③是过滤、⑤是萃取分液,
故答案为:过滤;萃取分液;
(2)氯气具有强氧化性,能将碘离子氧化为碘,离子方程式为Cl2+2I-═I2+2Cl-,
故答案为:Cl2+2I-═I2+2Cl-;
(3)浓硫酸和高锰酸钾具有强氧化性,但是会引进杂质离子,浓硫酸的还原产物还会产生有毒物质二氧化硫,双氧水具有氧化性,能将碘离子氧化,在氧化过程中不会引进杂质、不产生污染,
故答案为:B;
(4)萃取剂的选取标准:萃取剂和溶质不反应,萃取剂和原溶剂不互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,
A.酒精和水互溶,所以不能作萃取剂,故A错误;
B.醋酸和水互溶,所以不能作萃取剂,故B错误;
C.四氯化碳符合萃取剂的选取条件,所以可作萃取剂,故C正确;
D.苯符合萃取剂的选取条件,所以可作萃取剂,故D正确;
故答案为:CD.
点评 本题考查了离子性质的应用,混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,归中反应的分析判断,离子方程式的书写方法,题目难度中等.

| A. | 6 | B. | 16 | C. | 26 | D. | 30 |
| A. | CH3CO18OH | B. | H218O | C. | C2H518OH | D. | CH3CO18OC2H5 |
| 物质 | 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) |
| 密度/g•cm-3 | 0.789 | 1.595 | 0.71~0.76 | 4.93 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
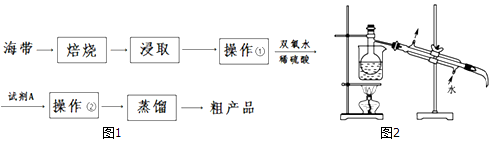
回答下列问题:
(1)实验室焙烧海带时,用不到的仪器有CE (填选项字母).
A.泥三角 B.三脚架 C.烧杯 D.坩埚 E.蒸发皿 F.酒精灯
(2)向浸取液中加入足量的双氧水和稀硫酸时,发生反应的离子方程式为2I-+H2O2+2H+═I2+2H2O.
(3)操作①中除用到玻璃棒外,还需要的玻璃仪器有烧杯、漏斗.
(4)试剂A的名称为四氯化碳 (从上表给出的试剂中选择).
(5)图2是进行蒸馏时的部分仪器,图中缺少的玻璃仪器的名称是温度计、锥形瓶.
(6)工业上可用碘制取碘酸钾,其反应为I2+2KClO3═2KIO3+Cl2↑,下列有关叙述不正确的是A (填选项字母).
A.氧化性:I2>Cl2
B.每生成1mol KIO3,转移5mol e-
C.该反应是置换反应
D.反应物和生成物中均含有共价键.
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
| A. | 升温时水的电离程度会增大,某温度下,pH═7的纯水中OH-浓度可能为10-6mol/L | |
| B. | 室温下,对于0.10 mol/L的醋酸,用NaOH溶液完全中和后,溶液不显中性 | |
| C. | HSO4-既能电离又能水解,且能与强碱溶液反应 | |
| D. | CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(OH-)的值增大 |
| A. | 可燃冰释放的甲烷属于烃 | |
| B. | 可燃冰是一种洁净的新能源 | |
| C. | 可燃冰实质是水变成的固态油 | |
| D. | 可燃冰燃烧实现了化学能转化为热能 |