题目内容
8.设NA表示阿伏加德罗常数的值,下列判断正确的是( )| A. | 将1molNH4NO3于稀氨水便溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4L甲烷中含有的C-H键数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中含有H+的数目为0.01NA | |
| D. | 1molFe与1molCl2充分反应转移电子数为3NA |
分析 A、1molNH4NO3于稀氨水便溶液呈中性,则有n(OH-)=n(H+),根据电荷守恒可知:n(Cl-)+n(OH-)=n(H+)+n(NH4+),据此分析;
B、求出甲烷的物质的量,然后根据甲烷中含4条C-H键来分析;
C、溶液体积不明确;
D、1mol铁和1mol氯气反应后,铁过量.
解答 解:A、1molNH4NO3于稀氨水便溶液呈中性,则有n(OH-)=n(H+),根据电荷守恒可知:n(Cl-)+n(OH-)=n(H+)+n(NH4+),故有n(Cl-)=n(NH4+)=1mol,故溶液中铵根离子的个数为NA个,故A正确;
B、标况下22.4L甲烷的物质的量为1mol,而甲烷中含4条C-H键,故1mol甲烷中含4NA条C-H键,故B错误;
C、溶液体积不明确,故溶液中的氢离子的个数无法计算,故C错误;
D、1mol铁和1mol氯气反应后,铁过量,而氯气反应后变为-1价,故1mol氯气反应后转移2NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.烯烃被酸性高锰酸钾溶液氧化的规律是,双键两端的基团=CH2变成CO2,=CHR变成RCOOH,
 变成
变成 ,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
 变成
变成 ,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
,现有某溴代烷A,分子式为C4H9Br,在NaOH醇溶液中加热得到有机物B,B被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | 只有CH3COOH | B. | CO2和 CH3COCH3 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
16.据探测月球土壤中吸附着数百万吨可作为核聚变材料的${\;}_{2}^{3}$He.下列有关${\;}_{2}^{3}$He的说法正确的是( )
| A. | 质量数为2 | B. | 质子数为2 | C. | 质子数为3 | D. | 质量数为1 |
3.元素X和Y是同周期主族元素,X元素在第ⅠA族,Y元素在第ⅦA族,则X和Y两元素原子序数之差不可能是( )
| A. | 6 | B. | 16 | C. | 26 | D. | 30 |
13.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
| A. | 将混合气体通过盛有硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
20.用括号内的试剂除去下列各物质中的少量杂质,其中最优的是( )
| A. | 溴苯中的Br2(氢氧化钠溶液) | B. | 苯中的甲苯(浓溴水) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 甲烷中的乙炔 (H2) |
17.工业上冶炼下列金属,必须另加还原剂的是( )
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
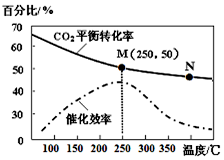 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下: