题目内容
4.下列过程中吸收热量的是( )| A. | 甲烷的燃烧 | B. | 浓硫酸的稀释 | ||
| C. | NH4Cl与Ba(OH)2•8H2O反应 | D. | 铝热反应 |
分析 需要吸收热量的反应为吸热反应;
常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应;绝大多数化合反应、置换反应;少数分解、复分解反应;
常见的吸热反应有:个别的化合反应(如C和CO2),绝大数分解反应,少数分解置换以及某些复分解(如铵盐和强碱),以此解答该题.
解答 解:A.燃烧反应为放热反应,故A错误;
B.浓硫酸溶于水放出大量的热,故B错误;
C.NH4Cl与Ba(OH)2•8H2O的反应属于吸热反应,故C正确;
D.铝热反应属于放热反应,故D错误.
故选C.
点评 本题考查化学反应中能量变化,为高频考点,侧重考查学生的分析能力,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
13.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
| A. | 将混合气体通过盛有硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
13. 常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
 常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )| A. | HNO2的电离方程式为HNO2=NO2-+H+ | |
| B. | a点H2O电离出的c(H+)=2.14×10-3mol•L-1 | |
| C. | b点溶液中离子浓度大小关系为c(NO2-)>c(Na+)>c(H+)>c(OH-) | |
| D. | X值等于20 |
17.工业上冶炼下列金属,必须另加还原剂的是( )
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
9.已知:P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1,P4(g)+10Cl2(g)═4PCl5(g)△H=bkJ•mol-1,P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ•mol-1,PCl3中P-Cl键的键能为1.2c kJ•mol-1.下列叙述正确的是( )
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能为 (b-a+5.6c)/4 kJ•mol-1 | |
| D. | 磷元素的非金属性比氯强 |
16.下列化合物既能与稀盐酸反应又能与NaOH溶液反应的是( )
①Al
②(NH4)2CO3
③Al2O3
④Ca(HCO3)2
⑤AgNO3
⑥Al(OH)3.
①Al
②(NH4)2CO3
③Al2O3
④Ca(HCO3)2
⑤AgNO3
⑥Al(OH)3.
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③④⑤⑥ | D. | ①②③⑥ |
13.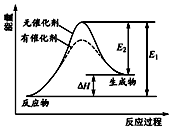 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 该反应的△H=E2-E1 | |
| D. | 该图可以表示燃料燃烧反应的能量变化 |
18.某元素最高价含氧酸的化学式是H2RO4,则该元素的气态氢化物化学式可表示为( )
| A. | HR | B. | H2R | C. | RH4 | D. | 不确定 |