题目内容
在2L Fe2(SO4)3和CuSO4的混合溶液中,加入30g纯铁粉,最后得到2L 0.25mol/L的FeSO4溶液和26g固体沉淀物.求原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度.
考点:有关混合物反应的计算
专题:
分析:因氧化性Fe3+>Cu2+,则加入铁粉,先发生Fe+Fe2 (SO4)3=3FeSO4,后发生Fe+CuSO4=FeSO4+Cu,最后得FeSO4溶液,则Fe2(SO4)3和CuSO4都完全反应,令原溶液中Fe2(SO4)3和CuSO4的物质的量分别为xmol、ymol,根据方程式表示出消耗的Fe、生成的Cu及FeSO4的物质的量,利用FeSO4物质的量及最后固体质量列方程计算,再根据c=
计算原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度.
| n |
| V |
解答:
解:设原溶液中Fe2(SO4)3和CuSO4的物质的量分别为xmol、ymol,则:
Fe+Fe2(SO4)3=3FeSO4,
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu,
ymol ymol ymol ymol
由FeSO4物质的量及最后固体质量,则:①3x+y=0.25×2、②30-56(x+y)+64y=26,
联立①②解得:x=0.1,y=0.2,
故原混合溶液Fe2(SO4)3的物质的量浓度为:c[F2(SO4)3]
=0.05mol/L,
CuSO4的物质的量浓度:c(CuSO4)=
=0.1mol/L,
答:原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度分别为0.05mol/L、0.1mol/L.
Fe+Fe2(SO4)3=3FeSO4,
xmol xmol 3xmol
Fe+CuSO4=FeSO4+Cu,
ymol ymol ymol ymol
由FeSO4物质的量及最后固体质量,则:①3x+y=0.25×2、②30-56(x+y)+64y=26,
联立①②解得:x=0.1,y=0.2,
故原混合溶液Fe2(SO4)3的物质的量浓度为:c[F2(SO4)3]
| 0.1mol |
| 2L |
CuSO4的物质的量浓度:c(CuSO4)=
| 0.2mol |
| 2L |
答:原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度分别为0.05mol/L、0.1mol/L.
点评:本题考查根据化学反应方程式的计算,题目难度中等,明确反应的先后顺序结合题目信息判断Fe2(SO4)3和CuSO4完全反应是解答本题的关键.

练习册系列答案
相关题目
现有三组溶液:①汽油和氯化钠溶液、②39%的乙醇溶液、③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
鉴别某溶液中是含有Br-还是I-,可以选用的试剂是( )
| A、稀盐酸 | B、四氯化碳 |
| C、淀粉溶液 | D、四氯化碳和氯水 |
室温下,下列各组离子或分子在指定分散系中能大量共存的是( )
| A、FeCl3溶液中:H+、Na+、Cl-、H2O2 | ||||
| B、酸性KMnO4的溶液中:Na+、NO3-、K+、CH3CH2OH | ||||
| C、混有氯化氢气体的氯气中:O2、CH4、N2、NH3 | ||||
D、c(H+)=0.10mol/L的溶液中:NH
|
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |
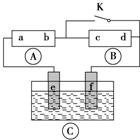
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路(未闭合K)后发现
为电镀槽.接通电路(未闭合K)后发现 上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( )
上的c点显红色.为实现铁上镀铜,使c、d两点短路.下列叙述不正确的是( ) 
| A、b为直流电源的负极 |
| B、f极为阴极,发生还原反应 |
| C、e极材料为铁片,f极材料的铜片 |
| D、可选用CuSO4溶液或CuCl2溶液作电镀液 |
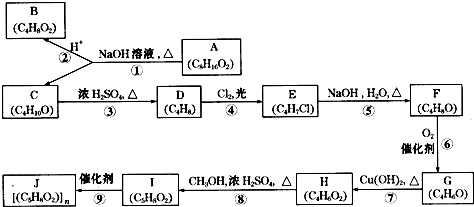
 某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: