题目内容
5.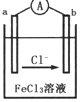 某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )| A. | Zn为负极,发生还原反应 | |
| B. | b电极反应式为ZFe3++2e-═2Fe2+ | |
| C. | 电子流动方向是a电极→FeCl3溶液→b电极 | |
| D. | 电池的正极材料可以选用石墨、铂电极,也可以用铜电极 |
分析 根据反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,铁离子在正极发生还原反应,阳离子向正极移动,由此分析解答.
解答 解:A、Zn为负极,发生氧化反应,故A错误;
B、氯离子向负极移动,所以b是负极,a是正极,则铁离子在a极上发生还原反应,电极反应式为:2Fe3++2e-═2Fe2+,故B错误;
C、电子由负极沿导线流向正极,所以电子流动方向是b电极→导线→a电极,故C错误;
D、正极材料本身未参与电极反应,所以可以选用石墨、铂电极,也可以用比锌活泼性弱的铜电极,故D正确;
故选D.
点评 本题综合考查原电池的工作原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的良好的科学素养,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.锂-二硫化亚铁电池是一种高容量电池,用途广泛,该电池放电时的总反应4Li+FeS2═Fe+2Li2S,下列说法正确的是( )
| A. | 放电时,负极反应为Li-e-═Li+ | |
| B. | 放电时,正极发生氧化反应 | |
| C. | 硫酸、羧酸及醇类物质都可以用作该锂电池的电解质 | |
| D. | 充电时,阳极只有Fe参与放电 |
13.下列物质的水溶液因水解显酸性的是( )
| A. | CH3COONa | B. | KCl | C. | NaHSO4 | D. | NH4Cl |
20.在恒容密闭容器中发生反应H2(g)+I2(g)?2HI(g),△H=-9.4KJ/mol,下列说法能说明该反应一定达到平衡的是( )
| A. | 混合气体的总分子数不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量为9.4KJ | D. | n(H2):n(I2):n(HI)=1:1:2 |
17.中国科学院成功开发出一种新型铝-石墨双离子电池,大幅提升了电池的能量密度.该电池充电时的总反应为:Al+xC+Li++PF6-═AlLi+CxPF6,有关该电池说法正确的是( )
| A. | 放电时,电子由石墨沿导线流向铝 | |
| B. | 放电时,正极反应式为:Al+Li++e-═AlLi | |
| C. | 充电时,铝电极质量增加 | |
| D. | 充电时,PF6-向阴极移动 |
4.有机物甲、乙的结构如图所示,下列说法错误的是( )
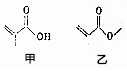

| A. | 甲、乙互为同分异构体 | |
| B. | 甲、乙都能发生取代、加成和水解反应 | |
| C. | 甲、乙都能使酸性的高锰酸钾褪色 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
 乙酸乙酯是非常重要的有机溶剂和化工原料,如图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品.请回答:
乙酸乙酯是非常重要的有机溶剂和化工原料,如图转化关系中的①、②、③是工业上合成乙酸乙酯的常见反应,其中A是一种常见的调味品.请回答: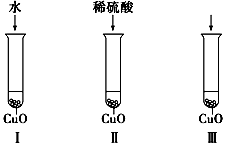 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.