题目内容
15.研究工业废弃物的处理和防治具有重要的意义.(1)利用反应CH4+2NO2=N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是NO2,当消耗CH 4的体积是11.2L(标准状况下)时,理论上可处理1molNO 2.
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体.该反应的化学方程式为 2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
分析 (1)根据元素化合价的变化来判断氧化剂的化合价降低;根据反应方程式分析判断;
(2)在催化剂条件下NO和CO反应,生成CO2和N2.
解答 解:(1)二氧化氮中氮由+4价变成0价,所以二氧化氮是氧化剂,据反应CH4+2NO2=N2+CO2+2H2O可知1mol的甲烷消耗2mol的二氧化氮,所以当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2,
故答案为:NO2;1;
(2)在催化剂条件下NO和CO反应,生成CO2和N2,反应的方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
点评 本题考查学生氧化还原反应中的概念以及化合价升降和电子转移知识,难度中等,注意知识的归纳和梳理是关键.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
3.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | CH4 (g)+2 O2(g)═CO2(g)+2 H2O (l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2 O2(g)═CO2(g)+2 H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | CH4(g)+2 O2 (g)═CO2(g)+2 H2O (l)△H=+890.3 kJ•mol-1 |
10.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族.下列说法正确的是( )
| A. | Z元素的简单离子是其所在周期中元素的简单离子半径最小的 | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Y与W形成的化合物一定能使酸性高锰酸钾溶液腿色 | |
| D. | 最高价氧化物对应水化物的酸性X比W的强 |
20.对下列实验的评价,正确的是( )
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO42- | |
| B. | 某无色溶液中滴入紫色石蕊试液显红色,该溶液可能有 CO 32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有 Ba2+ | |
| D. | 验证烧碱溶液中是否含有 Cl-,先加稍过量的稀硝酸除去 OH-,再加入 AgNO3溶液,如有 白色沉淀,则证明有 Cl- |
7.下列各组离子可能大量共存的是( )
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
4.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
5.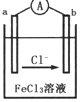 某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
 某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
某化学兴趣小组利用反应Zn+2FeC13═ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )| A. | Zn为负极,发生还原反应 | |
| B. | b电极反应式为ZFe3++2e-═2Fe2+ | |
| C. | 电子流动方向是a电极→FeCl3溶液→b电极 | |
| D. | 电池的正极材料可以选用石墨、铂电极,也可以用铜电极 |
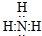 ,氯化铵
,氯化铵 .
.