题目内容
14.粗CuO是将工业废铜、废电线及废铜合金高温焙烧而成的,杂质主要是铁的氧化物及泥沙,以粗CuO为原料制备CuSO4•5H2O的主要步骤如下图所示:
已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(2)加入3% H2O2之前需将热溶液冷却,其目的是防止双氧水分解;加入H2O2后,发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加入2mol/L氨水后,溶液的pH应在3.2~4.7范围内.
(4)经过操作Ⅰ得到粗胆矾,经过操作Ⅱ得到精制胆矾.两步操作相同,都包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.其中“洗涤”的目的是洗去表面的杂质离子.
分析 在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,然后调节溶液pH1~2之间可得到纯净的硫酸铜溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可以得到胆矾晶体.
(1)氧化铜和硫酸反应生成硫酸铜和水,滤渣②的成分是氢氧化铁;
(2)双氧水具有氧化性,在加热条件下会发生分解反应生成水以及氧气;过氧化氢与Fe2+发生氧化还原反应;
(3)调节pH的范围应使Fe3+完全沉淀而Cu2+不生成沉淀,由表中数据可知应调节pH介于3.2~4.7之间;
(4)根据溶液得到晶体的方法:蒸发浓缩、冷却结晶、过滤,洗涤、干燥,洗涤洗去表面的杂质离子.
解答 解:(1)氧化铜和硫酸反应CuO+H2SO4=CuSO4+H2O,离子反应为:CuO+2H+=Cu2++H2O,在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,所以滤渣②的成分是氢氧化铁,
故答案为:CuO+2H+=Cu2++H2O;Fe(OH)3;
(2)双氧水具有氧化性,可以将亚铁离子氧化为铁离子,在加热条件下双氧水会发生分解反应生成水以及氧气,过氧化氢与Fe2+发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:防止双氧水分解;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据流程和目的,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,根据表中的数据,三价铁离子沉淀完全的pH是3.2,铜离子开始沉淀的pH为4.7,所以调节的pH范围是3.2~4.7,
故答案为:3.2~4.7;
(4)经操作Ⅰ得到粗胆矾,经操作Ⅱ得到精制胆矾,两步操作都包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,其中“洗涤”的目的是洗去表面的杂质离子,如铵根离子,
故答案为:蒸发浓缩、冷却结晶;洗去表面的杂质离子.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和物质分离提纯的操作方法,题目难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| 选项 | 甲 | 乙 |
| A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
| B | 电解质 | 冰醋酸、铝、水 |
| C | 酸性氧化物 | 二氧化碳、二氧化硫、三氧化硫 |
| D | 碱性氧化物 | 三氧化铁、氧化钠、氧化铝 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
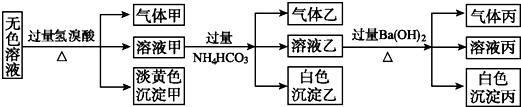
 ;
;
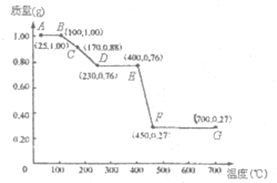 如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)