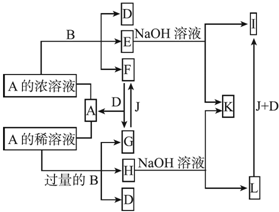
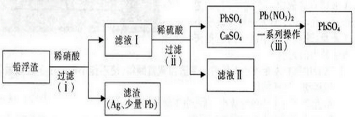
题目内容
8.某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-.现取该溶液进行有关实验,实验结果如图所示: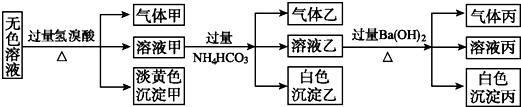
(1)沉淀甲是S,生成沉淀的离子方程式2S2-+SO32-+6H+=3S↓+3H2O.
(2)沉淀乙是Al(OH)3,由溶液甲生成沉淀乙的离子方程式Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(3)沉淀丙是BaCO3,可能有BaSO4,设计实验证明在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4,若全部溶解,则仅有BaCO3.
(4)综合上述信息,可以肯定存在的离子有Na+、S2-、SO32-、AlO2-.
分析 由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,然后结合离子的共存来分析.
解答 解:由无色溶液加HBr产生淡黄色沉淀,则沉淀甲为S,则发生2S2-+SO32-+6H+=3S↓+3H2O,一定存在S2-、SO32-;溶液甲与过量碳酸氢铵反应,则沉淀乙为Al(OH)3,气体乙为二氧化碳,溶液乙中加过量氢氧化钡反应生成白色沉淀丙应为BaCO3,气体丙为氨气,Ag+、Ba2+、Al3+与S2-、SO32-不能共存,则不存在,由电荷守恒可知,一定存在的阳离子为Na+,一定存在的阴离子为S2-、SO32-、AlO2-,
(1)由上述分析可知,沉淀甲为S,生成沉淀的离子反应为2S2-+SO32-+6H+=3S↓+3H2O,故答案为:S;2S2-+SO32-+6H+=3S↓+3H2O;
(2)沉淀乙为Al(OH)3,生成沉淀乙的离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al(OH)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)原溶液中有可能有硫酸根离子,溶液乙中含碳酸氢根离子,则沉淀丙为BaCO3,可能有BaSO4,在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3 外还有BaSO4;若全部溶解,则仅有BaCO3,
故答案为:BaCO3,可能有BaSO4;在沉淀丙中加入足量盐酸,若沉淀不能全部溶解,说明除BaCO3外还有BaSO4,若全部溶解,则仅有BaCO3;
(4)肯定存在的离子有Na+、S2-、SO32-、AlO2-,故答案为:Na+、S2-、SO32-、AlO2-.
点评 本题以离子的共存及离子反应考查推断,把握实验流程及离子之间的反应推断出存在离子是解答的关键,注意过量离子及电荷守恒的应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 加热浓缩到溶液体积为$\frac{V}{2}$ L | |
| B. | 加入0.05 mol•L-1盐酸0.125V L | |
| C. | 加入10 mol•L-1盐酸0.1V L,再稀释至1.5V L | |
| D. | 标准状况下通入11.2 L氯化氢气体 |
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
①NH4NO3晶体; ②浓H2SO4; ③NaOH粉末;
④NaCl晶体 ⑤Na2O2固体; ⑥生石灰.

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
| A. | 容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等 | |
| B. | 平衡时,两个容器中NH3 的体积分数均为1/8 | |
| C. | 容器②中达平衡时放出的热量Q=4.63 kJ | |
| D. | 若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ |

已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(2)加入3% H2O2之前需将热溶液冷却,其目的是防止双氧水分解;加入H2O2后,发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加入2mol/L氨水后,溶液的pH应在3.2~4.7范围内.
(4)经过操作Ⅰ得到粗胆矾,经过操作Ⅱ得到精制胆矾.两步操作相同,都包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.其中“洗涤”的目的是洗去表面的杂质离子.

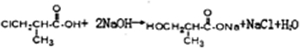 ;高分子化合物H的结构简式为
;高分子化合物H的结构简式为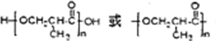 .
.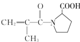 ,F有多种同分异构体,如
,F有多种同分异构体,如 等.写出满足下列条件的F的同分异构体的结构简式:
等.写出满足下列条件的F的同分异构体的结构简式: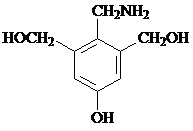 、
、 .
.