题目内容
19.分类法是研究化学的一种方法,下列乙中的物质与甲的分类关系匹配的是( )| 选项 | 甲 | 乙 |
| A | 干燥剂 | 浓硫酸、石灰石、无水氯化钙 |
| B | 电解质 | 冰醋酸、铝、水 |
| C | 酸性氧化物 | 二氧化碳、二氧化硫、三氧化硫 |
| D | 碱性氧化物 | 三氧化铁、氧化钠、氧化铝 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A、石灰石不是干燥剂;
B、氨气是非电解质;
C、大多数的非金属氧化物属于酸性氧化物;
D、大多数的金属氧化物属于碱性氧化物.
解答 解:A、浓硫酸、无水氯化钙可以做干燥剂,石灰石不是干燥剂,故A错误;
B、金属铝是单质,不是化合物,不是电解质,醋酸,水是弱电解质,故B错误;
C、二氧化碳、二氧化硫、三氧化硫都可以和碱反应生成盐和水,属于酸性氧化物,故C正确;
D、三氧化铁、氧化钠属于碱性氧化物,但是氧化铝属于两性氧化物,故D错误;
故选C.
点评 本题考查了物质分类的分析判断,注意概念理解,掌握物质性质和组成是解题关键,题目较简单.

练习册系列答案
相关题目
14.下列分子中含有两个π键的是( )
| A. | O2 | B. | N2 | C. | H2O | D. | NH3 |
14.粗CuO是将工业废铜、废电线及废铜合金高温焙烧而成的,杂质主要是铁的氧化物及泥沙,以粗CuO为原料制备CuSO4•5H2O的主要步骤如下图所示:

已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
(1)写出CuO溶解时的离子方程式CuO+2H+=Cu2++H2O.滤渣②的成分是Fe(OH)3.
(2)加入3% H2O2之前需将热溶液冷却,其目的是防止双氧水分解;加入H2O2后,发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加入2mol/L氨水后,溶液的pH应在3.2~4.7范围内.
(4)经过操作Ⅰ得到粗胆矾,经过操作Ⅱ得到精制胆矾.两步操作相同,都包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.其中“洗涤”的目的是洗去表面的杂质离子.

已知:Fe3+、Fe2+、Cu2+转化为氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
(2)加入3% H2O2之前需将热溶液冷却,其目的是防止双氧水分解;加入H2O2后,发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加入2mol/L氨水后,溶液的pH应在3.2~4.7范围内.
(4)经过操作Ⅰ得到粗胆矾,经过操作Ⅱ得到精制胆矾.两步操作相同,都包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.其中“洗涤”的目的是洗去表面的杂质离子.
11.下列电离或水解方程式书写不正确的是( )
| A. | 碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3- HCO3-?H++CO32- | |
| B. | 偏铝酸钠的水解方程式为:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑ | |
| D. | 醋酸铵的水解方程式为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O |
8.在刚刚过去的一年中,发生了许多与化学相关的大事件.下列说法正确的是( )

| A. | 被称为“史上最严”的新《环境保护法》正式实施,我们要运用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
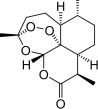
| C. | 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| D. | 某品牌化妆品在广告中反复强调产品中不含任何化学成分,是“十年专注自然护肤”的优质产品 |
9.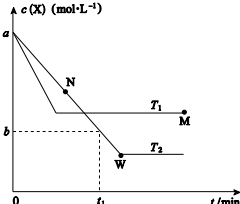 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
 在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )
在恒容密闭容器中通入X 并发生反应:2X(g)?Y(g),温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是 ( )| A. | 该反应进行到M 点放出的热量大于进行到W 点放出的热量 | |
| B. | T2 下,在0~t1 时间内,v(Y)═$\frac{a-b}{{t}_{1}}$mol•L-1•min-1 | |
| C. | M 点的平衡常数小于W 点的平衡常数 | |
| D. | M 点时再加入一定量X,平衡后X 的转化率减小 |
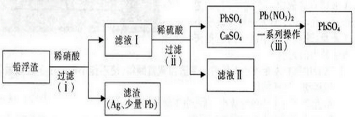
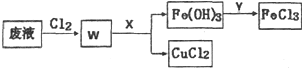 铜及其化合物在工农业生产中有着广泛的用途.
铜及其化合物在工农业生产中有着广泛的用途.