题目内容
7.区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
分析 NaCl、FeCl3和NH4Cl三种溶液,阳离子不同,加NaOH溶液的现象分别为无现象、红褐色沉淀、刺激性气体,以此来解答.
解答 解:A.NH4Cl和NaCl与KSCN溶液均不反应,不能区别,故A错误;
B.NaCl、FeCl3和NH4Cl三种溶液分别与NaOH溶液反应的现象为:无现象、红褐色沉淀、有刺激性气味的气体,现象不同,能区分,故B正确;
C.AgNO3溶液与三者溶液反应均生成白色沉淀,现象相同,不能区分,故C错误;
D.三种溶液均不与BaCl2溶液反应,不能区别,故D错误.
故选B.
点评 本题考查物质的检验及鉴别,为高频考点,明确物质的性质是解答此类习题的关键,注意现象不同即可鉴别,若现象相同不能鉴别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
18.电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )
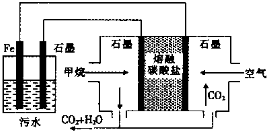

| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
15.a g Mg、Al合金完全溶解在c1 mol•L-1、V1L HCl溶液中,产生b mol H2.再向反应后的溶液中加入c2mol•L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系不正确的是( )
| A. | 铝的质量为$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 与金属反应后剩余盐酸为(c1V1-2b)mol |
2.现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
12.下列实验现象与氧化还原反应有关的是( )
| A. | 氨水中滴加石蕊试液显蓝色 | |
| B. | NO2通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 萃取时向碘水中滴加适量的稀盐酸,有透明的凝胶形成 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
16.下列化合物中依次属于氧化物、碱、盐的一组是( )
| A. | Na2O2、KOH、CaO | B. | CO、NaOH、KCl | C. | H2O、H2SO4、NaCl | D. | CuO、Na2O2、CaCO3 |
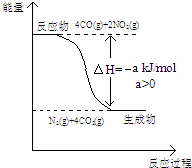 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.