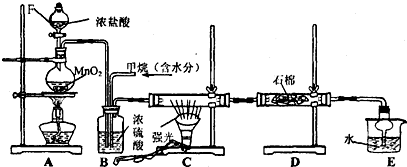
题目内容
15.氯碱工业中电解饱和食盐水的原理示意图如图所示.(1)溶液A的溶质是NaOH;
(2)电解所用的盐水需精制.去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].

精致流程如下(淡盐水和溶液A来自电解池):
 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.②过程Ⅰ中将NH4+转化为N2的离子方程式是2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O.
③BaSO4的溶解度比BaCO3的小.过程Ⅱ中除去的离子有SO42-、Ca2+.
分析 电解饱和食盐水时,阴极反应式为:2H2O-2e-═2OH-+H2↑,阳极反应式为:2Cl--2e-═Cl2↑,阴极产物为NaOH和H2,阳极产物是Cl2.
(1)根据电极反应判断阴极产物;
(2)①根据杂质离子和溶液的酸碱性判断能反应生成的沉淀;
②根据A溶液成分和可能具有的性质,结合氧化还原反应和质量守恒定律书写离子方程式;
③根据溶液成分和溶解度大小判断生成的沉淀.
解答 解:(1)电解饱和食盐水时,阴极反应式为:2H2O-2e-═2OH-+H2↑,阳极反应式为:2Cl--2e-═Cl2↑,阴极产物为NaOH和H2,阳极产物是Cl2,据此可以确定溶液A的溶质是NaOH,故答案为:NaOH;
(2)①根据粗盐水和淡盐水的化学成分,代入题给精制盐水的流程进行分析,可知过程I是将Mg2+转化为Mg(OH)2沉淀除去,即盐泥a中除泥沙外,还含有的物质是Mg(OH)2,
故答案为:Mg(OH)2;
②将NH4+转化为N2的氧化剂是Cl2,对应的离子方程式是2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O,
故答案为:2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O;
③过程II是利用沉淀溶解平衡原理,将溶液中的Ca2+和SO42-分别转化为CaCO3和BaSO4沉淀除去,
故答案为:SO42-、Ca2+.
点评 本题考查饱和食盐水的电解和粗盐的提纯,题目较为综合,注意平衡移动原理的应用以及电极反应式、离子反应式的书写,做题时注意题中所给信息,用守恒的方法解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.用化学用语解释相关现象正确的是( )
| A. | BaSO4的水溶液导电性极弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融状态下可导电:KHSO4=K++H++SO42+ | |
| C. | 常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH- |
10.下列叙述正确的是( )
| A. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,若滴定终点时仰视读数,测得氢氧化钠浓度偏低 | |
| C. | 配制2.0 mol•L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
20. 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
2NH3(g)+C02(g)$\stackrel{一定条件}{?}$C0(NH2)2 (g)+H20(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①70min 时,平均反应速率(CO2 )=5.7×10-4mol/(L•min)mol/(L min).
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大 (填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
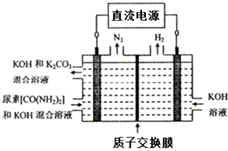
④如图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
 工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].2NH3(g)+C02(g)$\stackrel{一定条件}{?}$C0(NH2)2 (g)+H20(g)△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| 万(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大 (填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为277.8(保留一位小数).
④如图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.