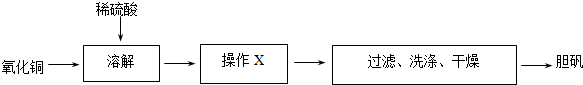
题目内容
3.氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
(1)氯水中含有七种粒子,其中的分子为Cl2、H2O、HClO (化学式);需临时配制的原因是2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ (用化学方程式表示).
(2)图甲所示装置中,烧杯内的液体是NaOH溶液,烧杯中发生反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O.
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内.
②关闭活塞1,盖上分液漏斗上口玻璃塞.浓盐酸和大试管内的高锰酸钾粉末反应产生氯气.
③轻轻摇动瓶A,使氯气不断溶入水中.
用图乙装置能在较短时间内得到饱和氯水.除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是氯气在瓶内产生较大压强,增大了氯气的溶解度.分液漏斗中的浓盐酸应分数次加入试管内.若一次加入太多的浓盐酸,可能引起的后果是在瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡皮塞弹开.
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气.
分析 (1)氯气与水反应生成盐酸和次氯酸,结合溶液中物质的电离分析;氯水中的次氯酸不稳定易分解为盐酸和氧气;
(2)氯气有毒,直接排放能引起空气污染,可以和强碱反应,用碱液吸收;
(3)增大压强可以增大氯气的溶解度;一次加入太多的盐酸会使得产生的氯气的量多,出现很大的压强;
(4)根据大气压强原理来寻找排出液体的方法.
解答 解:(1)氯气与水反应生成盐酸和次氯酸,盐酸电离出氯离子和氢离子,次氯酸部分电离,水部分电离,所以氯水中含有七种粒子,其中的分子为Cl2、H2O、HClO;氯水中的次氯酸不稳定易分解为盐酸和氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以氯水久置会因为次氯酸分解而失效,
故答案为:Cl2、H2O、HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑;
(2)氯气有毒,多余的氯气不排放到空气中去,氯气可以和强碱氢氧化钠反应来吸收氯气,其反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:NaOH溶液;Cl2+2OH-=ClO-+Cl-+H2O;
(3)图乙装置能在较短时间内得到饱和氯水,除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是氯气在瓶内产生较大的压强,增大了氯气的溶解度,分液漏斗中的盐酸应分数次加入试管内,若一次加入太多的盐酸,和高锰酸钾反应产生的氯气量太多,会导致瓶内压强过大会使瓶A的橡皮塞弹开,
故答案为:氯气在瓶内产生较大的压强,增大了氯气的溶解度;在瓶内产生过多的氯气,瓶内压强过大会使瓶A的橡皮塞弹开;
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气,瓶内压强增大,会将液体从A瓶中排出,
故答案为:打开活塞2,关闭活塞1,用鼓气球向瓶A中鼓入空气.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、SO42-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Cu2+、NO3-、SO42- |
| A. | 2molSO2(g)和1mol O2(g)所具有的键能总和大于2 molSO3(g)所具有的键能总和 | |
| B. | 将2molSO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QKJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)于某密闭容器中充分反应后放热QKJ,则此过程中有2molSO2(g)被氧化 |

| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和1:2的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
 ①盐泥a除泥沙外,还含有的物质是Mg(OH)2.
①盐泥a除泥沙外,还含有的物质是Mg(OH)2.