题目内容
 已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:
已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
X、Y两元素中X的第一电离能较大的原因是
(2)基态Z原子的核外电子排布式为
(3)试写出U元素单质的2种等电子体,并举例说明其结构或性质与U元素单质的相似之处:①
②
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是
②与H2O分子相比,VW2分子的极性更
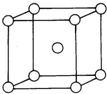
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式,如图.则晶胞中Z的配位数为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.V原子p能级电子总数与s能级电子总数相等,则V为O元素;U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍,则U为N元素,Z为Cr元素;根据X和Y原子的第一至第四电离可知,X的第3电离能较大,则X为Mg元素;Y的第4电离能明显增大,则Y为Al元素;W为F元素;再结合题目分析解答.
解答:
解:U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.V原子p能级电子总数与s能级电子总数相等,则V为O元素;U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍,则U为N元素,Z为Cr元素;根据X和Y原子的第一至第四电离可知,X的第3电离能较大,则X为Mg元素;Y的第4电离能明显增大,则Y为Al元素;W为F元素;再结合题目分析解答.
(1)非金属性:F>O>N,故电负性:F>O>N;Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定,故第一电离能:F>O>N;X为Mg、Y为Al,Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定;
(2)Cr的核外电子数为24,有24种不同运动状态的电子,其原子的核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;24;
(3)N2有14个电子,其等电子体有都呈电中性的CO,都较稳定的CN-,故答案为:CO,都呈电中性;CN-,都具有稳定性;
(4)①OF2中,O原子与F形成2条共价键,还有2个孤对电子,形成4个杂化轨道,采用sp3杂化,构成V形空间结构;故答案为:sp3;V形;
②F的电负性大于O,导致正负电荷中心偏离程度减小,OF2分子的极性小于H2O;故答案为:小;F的电负性大于O,导致正负电荷中心偏离程度减小;
(5)该晶胞中,晶胞中心Cr与周围8个Cr最近,其配位数为8;其密度为ρ=
=
g/cm3=7.1g/cm3,Cr原子与次近的Cr原子为另一个晶胞的中心Cr原子,其核间距离为边长为289pm,故答案为:8;7.0至7.2均可;289pm.
(1)非金属性:F>O>N,故电负性:F>O>N;Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定,故第一电离能:F>O>N;X为Mg、Y为Al,Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定;
(2)Cr的核外电子数为24,有24种不同运动状态的电子,其原子的核外电子排布式为[Ar]3d54s1,故答案为:[Ar]3d54s1;24;
(3)N2有14个电子,其等电子体有都呈电中性的CO,都较稳定的CN-,故答案为:CO,都呈电中性;CN-,都具有稳定性;
(4)①OF2中,O原子与F形成2条共价键,还有2个孤对电子,形成4个杂化轨道,采用sp3杂化,构成V形空间结构;故答案为:sp3;V形;
②F的电负性大于O,导致正负电荷中心偏离程度减小,OF2分子的极性小于H2O;故答案为:小;F的电负性大于O,导致正负电荷中心偏离程度减小;
(5)该晶胞中,晶胞中心Cr与周围8个Cr最近,其配位数为8;其密度为ρ=
| m |
| V |
| 2×52 |
| (2.89×10-10)3NA |
点评:本题考查了物质结构和性质,正确推断元素是解本题关键,明确晶胞的计算方法、第一电离能、氢化物的稳定性、核外电子排布式的书写规则即可解答,注意第一电离能的规律及异常现象,题目难度中等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
现有A、B、C三种化合物,各取40g相混合,完全反应后,只剩下18.0g B、49.0g C、还有生成的D,已知D的式量为106.现将22.0g A和11.0gB反应,能生成D的物质的量为( )
| A、1.00mol |
| B、0.500mol |
| C、0.275mol |
| D、0.250mol |
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、室温下,28 g N2所含的分子数多于NA |
| B、标况下,16 g O2所含原子数是NA |
| C、电子数是NA的NH3的物质的量是1 mol |
| D、17 g OH-中质子总数比电子总数多NA |
下列关于氧化物的叙述正确的是( )
| A、能跟强碱溶液反应的氧化物就是酸性氧化物 |
| B、酸性氧化物都可以与水反应可生成酸 |
| C、金属氧化物不一定是碱性氧化物 |
| D、不能跟酸反应的氧化物一定能和碱反应 |
用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作指示剂,可导致被测定的盐酸浓度偏高的是( )
| A、未用标准液润洗用蒸馏水洗过的碱式滴定管 |
| B、达到滴定终点,读数时俯视滴定管的刻度 |
| C、滴定过程中振荡锥形瓶有少许盐酸溅出 |
| D、盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
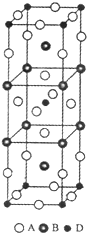 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2.
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子总数相差为8;与B位于同一周期的C和D,它们的价电子层排布中未成对电子数分别为4和2,且原子序数相差为2. ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.