题目内容
6.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
分析 从平衡状态的两个重要特征上判断:(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变.
解答 解:此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断
①v(正)=v(逆);
②说明符合特征(2);
③表示的都是正反应方向;
④NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2);
⑤若是恒容条件,则ρ始终不变;若恒压条件,则ρ随反应而变;
⑥表示混合物中各组成成分的百分含量不变;
故①②④⑥能说明是否达到平衡状态.
故选A.
点评 本题考查化学平衡状态的判断,注意分析时要从化学方程式的反应特征判断,平衡状态的本质时正逆反应速率相等.

练习册系列答案
相关题目
16.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为吸热反应 | B. | CO2的分子模型示意图: | ||
| C. | HCHO分子中既含σ键又含π键 | D. | 每生成1.8 g H2O消耗2.24 L O2 |
17.短周期主族元素W、R、M、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差2.下列叙述正确的是( )
| A. | W与R形成的化合物只能含离子键 | |
| B. | M、X与R的最高价氧化物的水化物所组成的原电池中M作负极 | |
| C. | 简单气态氢化物的沸点:Y<W | |
| D. | 化合物Y2Z2中只含极性共价键 |
14.在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性,如图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )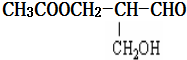
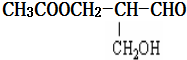
| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 在铜作催化剂与氧气加热反应 | D. | 在催化剂存在下与氢气反应 |
1.已知${\;}_{58}^{140}$Ce是地壳中含量最高的稀土金属元素.下列关于${\;}_{58}^{140}$Ce的说法正确的是( )
| A. | 质量数为198 | B. | 中子数为82 | ||
| C. | 与${\;}_{58}^{142}$Ce为同素异形体 | D. | Ce元素相对原子质量为140 |
11.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
15.某反应的△H=+100kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
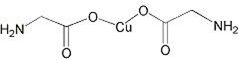 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: