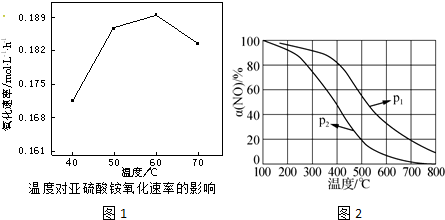
题目内容
15.某反应的△H=+100kJ•mol-1,下列有关该反应的叙述正确的是( )| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
分析 某反应△H=+100kJ•mol-1,应为吸热反应,说明反应物总能量小于生成物总能量,结合焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能判断.
解答 解:某反应的△H=+100kJ•mol-1,则正反应的活化能-逆反应的活化能=+100kJ•mol-1,说明正反应的活化能比逆反应的活化能大100kJ•mol-1,无法确定正、逆反应活化能的大小,只有C正确.
故选C.
点评 本题考查了反应能量变化和焓变、活化能的含义理解,为高频考点,侧重学生的分析能量和基本概念的综合理解和运用的考查,注意把握反应的实质,题目难中等.

练习册系列答案
相关题目
5.下列关于能层与能级的说法中正确的是( )
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
6.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2
②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
3.现有部分短周期元素的性质与原子(或分子)结构如下表:
(1)画出元素T的原子结构示意图 ;
;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
 ;
;(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号);
a.Y单质的熔点比Z单质低b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式Na2O2,并写出该化合物与水反应的化学方程式2Na2O2+2H2O═4NaOH+O2↑;
(4)元素T和氢元素形成的化合物属于共价化合物,元素Z与元素T形成的化合物属于离子化合物(以上两空选填“共价化合物”或“离子化合物”).
7.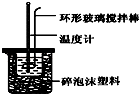 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是Cu传热快,热量损失大.
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
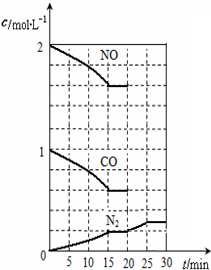 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法. ;
;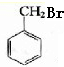 +H2O、
+H2O、 、
、 .
.