题目内容
10.姜黄素是植物界中很稀少的二酮色素,在食品生产中主要用于罐头、酱卤制品等的着色,还可以抑制肿瘤生长.其化学合成路线如下(部分产物和条件略去)请回答:
(1)H分子的核磁共振氢谱峰面积之比为1:3或3:1;C的化学名称为乙二醛;D的结构简式为OHCCOOH.
(2)由A到B的反应类型为取代反应或水解反应;由D和E生成F的化学方程式为
 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 (3)写出同时满足如下条件的E的同分异构体的结构简式

①遇FeCl3溶液显紫色②苯环上的一氯代物有两种.
(4)已知:
 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛;②Claisen缩合:
 (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为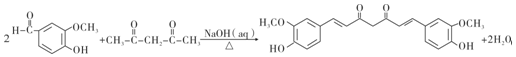
(5)聚丙烯醛
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线HCHO+CH3CHO$\stackrel{Claisen缩合}{→}$CH2=CHCHO$\stackrel{加聚}{→}$
 .
.
分析 CH2=CH2和溴发生加成反应生成A,A结构简式为CH2BrCH2Br,CH2BrCH2Br和NaOH的水溶液发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHCCHO,C发生氧化反应生成D,根据D分子式知,D为OHCCOOH,E和D反应生成F,根据F结构简式结合E分子式知,E结构简式为 ,F反应生成G,G和H反应生成姜黄素,根据(4)题信息结合G分子式知,G结构简式为
,F反应生成G,G和H反应生成姜黄素,根据(4)题信息结合G分子式知,G结构简式为 ,姜黄素结构简式为
,姜黄素结构简式为 ,
,
(5)甲醛和乙醛发生Claisen缩合反应生成丙烯醛,丙烯醛发生加聚反应生成聚丙烯醛.
解答 解:CH2=CH2和溴发生加成反应生成A,A结构简式为CH2BrCH2Br,CH2BrCH2Br和NaOH的水溶液发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHCCHO,C发生氧化反应生成D,根据D分子式知,D为OHCCOOH,E和D反应生成F,根据F结构简式结合E分子式知,E结构简式为 ,F反应生成G,G和H反应生成姜黄素,根据(4)题信息结合G分子式知,G结构简式为
,F反应生成G,G和H反应生成姜黄素,根据(4)题信息结合G分子式知,G结构简式为 ,姜黄素结构简式为
,姜黄素结构简式为 ,
,
(1)H中有2种氢原子,这两种氢原子个数之比为1:3或3:1,C为OHCCHO,名称是乙二醛,D结构简式为OHCCOOH,
故答案为:1:3或3:1;乙二醛; OHCCOOH;
(2)由A到B的反应类型为取代反应或水解反应;由D和E生成F的化学方程式为 ,该反应的反应类型为加成反应,
,该反应的反应类型为加成反应,
故答案为:取代反应(水解反应); ;加成反应;
;加成反应;
(3)E结构简式为 ,E的同分异构体符合下列条件:
,E的同分异构体符合下列条件:
①遇FeCl3溶液显紫色,说明含有酚羟基;
②苯环上的一氯代物有两种,说明苯环上有两种氢原子,
符合条件的同分异构体结构简式为 ,
,
故答案为: ;
;
(4)由G制取姜黄素的化学方程式为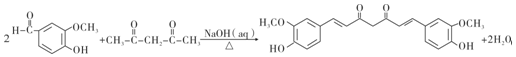
故答案为: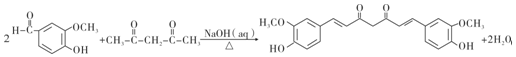 ;
;
(5)甲醛和乙醛发生Claisen缩合反应生成丙烯醛,丙烯醛发生加聚反应生成聚丙烯醛,其合成路线为HCHO+CH3CHO$\stackrel{Claisen缩合}{→}$CH2=CHCHO$\stackrel{加聚}{→}$ ,
,
故答案为:HCHO+CH3CHO$\stackrel{Claisen缩合}{→}$CH2=CHCHO$\stackrel{加聚}{→}$ .
.
点评 本题考查有机推断和有机合成,为高频考点,侧重考查学生分析推断及知识迁移、综合运用能力,明确官能团及其性质关系、物质之间的转化是解本题关键,难点是合成路线设计,注意结合题给信息分析解答,题目难度不大.

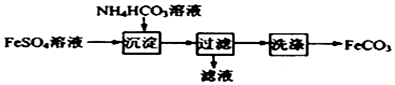
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
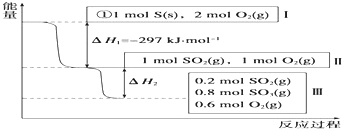
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②在相同条件下,充入1mol SO3和0.5mol 的O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66KJ的能量.
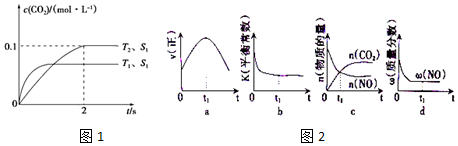
(2)①CO2可转化成有机物实现碳循环,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.
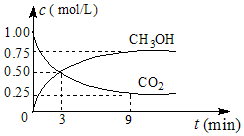
②能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是ABC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.

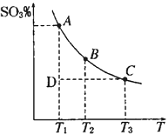 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: