题目内容
9.下列各组离子,在水溶液中能大量共存的是( )| A. | Fe3+、OH- | B. | Na+、SO42- | C. | Ag+、Cl- | D. | H+、OH- |
分析 A.铁离子与氢氧根离子反应生成氢氧化铁沉淀;
B.钠离子不与硫酸根离子反应;
C.银离子与氯离子反应生成难溶物氯化银;
D.氢离子与氢氧根离子发生中和反应.
解答 解:A.Fe3+、OH-之间反应生成难溶物氢氧化铁,在溶液中不能大量共存,故A错误;
B.Na+、SO42-之间不反应,在溶液中能够大量共存,故B正确;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C错误;
D.H+、OH-之间反应生成水,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.已知2A2(g)+B2(g)?2C3(g)△H=-a kJ/mol(a>0),在一个有催化剂,固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为x mol/L,放出的热量为bkJ.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
若在原来容器内,只加入2molC3,500℃时充分反应达到平衡后,吸收热量c kJ,则C3的浓度=x mol/L(填“>”、“<”或“=”),a、b、c之间满足何种关系a=b+c
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
(1)a>b(填“>”、“<”或“=”).
(2)下表为不同温度下该反应的平衡常数.由此可推知,表中T1<T2(填“>”、“<”或“=”).
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
a=b+c(用代数式表示).
(3)在相同条件下要想得到2a kJ的热量,加入各物质的物质的量可能是D.
A.4mol A2和2mol B2 B.4mol A2、2mol B2 和2molC3
A.4mol A2和4mol B2 D.6mol A2和4mol B2
(4)能使该反应反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达到平衡后,放出热量为d kJ,则d>b(填“>”、“<”或“=”),理由是恒压容器压强保持不变,随着反应的进行容器体积减小,平衡向正反应方向移动,故放出较多热量.
20.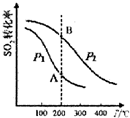 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.
(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
计算上述反应在0~10min内,v(O2)=0.08mol•L-1•min-1.
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0
SO2的平衡转化率与温度、压强的关系如图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
能说明该反应达到化学平衡状态的是d(填序号).
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O=2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
1.室温下,0.1mol/L氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
①电离程度增大 ②$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 ③c(H+) 增大④导电性增强 ⑤$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大.
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅①③⑤ | D. | 仅②③④ |
18.污染大气并形成酸雨的主要物质是( )
| A. | CO | B. | NH3 | C. | SO2 | D. | HCl |
19.生产中通常用铁制容器盛装下列哪一溶液?( )
| A. | 氯化铜溶液 | B. | 稀硫酸 | C. | 浓盐酸 | D. | 浓硝酸 |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.