题目内容
17.(1)根据以下两个反应C(s )+O2 (g)=CO2(g)△H=-393.5KJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol
写出C(s)与 O2(g)反应生成CO(g)的热化学方程式:C(s )+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
(2)在温度、压强一定的条件下,化学反应方向的判断:
①②△H-T△S=0则反应达到平衡.
②②△H-T△S<0则反应能自发进行.
③△H-T△S>0则反应不能自发进行.
分析 (1)结合热化学方程式和盖斯定律计算所需热化学方程式;
(2)反应能够自发进行的判断依据为:△H-T△S<0,与熵变和焓变都有关系,据此解答.
解答 解:(1)①C(s )+O2 (g)=CO2(g)△H=-393.5KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283KJ/mol
盖斯定律计算得到:①-②得到C(s)与 O2(g)反应生成CO(g)的热化学方程式为:
C(s )+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol,
故答案为:C(s )+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(2)反应能否自发进行与由熵变和焓变共同决定,
①△H-T△S=0,则反应达到平衡,故答案为:△H-T△S=0;
②△H-T△S<0,则反应能自发进行,故答案为:△H-T△S<0;
③△H-T△S>0,则反应不能自发进行,故答案为:△H-T△S>0;
点评 本题考查热化学方程式书写和盖斯定律的计算、化学反应方向的判据:△H-T△S<0反应自发进行,注意熵变与焓变都与反应能够自发进行有关,但都不是唯一因素,题目难度中等.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
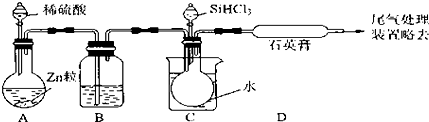
7. 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
(1)写出A中反应的化学方程式: .
.
(2)已知上述反应是放热反应.观察到A中的现象是反应液微沸,有红棕色气体充满A容器
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴.
(4)C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气.
(5)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法
 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.(1)写出A中反应的化学方程式:
 .
.(2)已知上述反应是放热反应.观察到A中的现象是反应液微沸,有红棕色气体充满A容器
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴.
(4)C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气.
(5)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法
| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
2.U、W、Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
(1)元素U的原子核外共有3种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是bd
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)△H2=-190kJ/mol
①该反应 450℃时的平衡常数> 500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是abd
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.09mol/(L.min):平衡常数为16200.若继续通入0.20molYO2和0.10molO2,再次达到平衡后,YO3物质的量约为0.368mol.
| U | |||
| W | Y |
(2)能提高W与稀硫酸反应速率的方法是bd
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)△H2=-190kJ/mol
①该反应 450℃时的平衡常数> 500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是abd
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.09mol/(L.min):平衡常数为16200.若继续通入0.20molYO2和0.10molO2,再次达到平衡后,YO3物质的量约为0.368mol.
9.下列各组离子,在水溶液中能大量共存的是( )
| A. | Fe3+、OH- | B. | Na+、SO42- | C. | Ag+、Cl- | D. | H+、OH- |
7.物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A. | NH4Cl | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |

 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C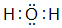 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.