题目内容
18.污染大气并形成酸雨的主要物质是( )| A. | CO | B. | NH3 | C. | SO2 | D. | HCl |
分析 酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6;酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成,据此分析解答即可.
解答 解:酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6;酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成.
A、一氧化碳污染空气,但不是形成酸雨的气体,故A错误;
B、氨气污染空气,溶于水现场一水合氨显碱性,不是形成酸雨的气体,故B错误;
C、二氧化硫经过复杂的大气化学反应,被雨水吸收溶解,能形成酸雨,故C正确;
D、HCl污染空气,不是形成酸雨的气体,故D错误;
故选C.
点评 本题考查了酸雨的形成,完成此题,可以依据已有的知识进行,题目难度不大,酸雨是工业发展出现的副产物,了解酸雨的形成原因是正确解答本题的关键.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
9.下列各组离子,在水溶液中能大量共存的是( )
| A. | Fe3+、OH- | B. | Na+、SO42- | C. | Ag+、Cl- | D. | H+、OH- |
3.关于氯化镁溶液和氢氧化铁胶体的说法中正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
10.随着我国经济的飞速发展,居民家用小汽车拥有量大幅攀升,汽车尾气带来的空气污染不容忽视.汽车尾气中,两种污染物能在催化剂作用下转化为无害物质,这两种污染物是( )
| A. | CO2和NO | B. | CO和NO | C. | CO2和O2 | D. | 碳氢化合物和O3 |
7.物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
| A. | NH4Cl | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
13.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2(g)$\stackrel{高温}{?}$ W (s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
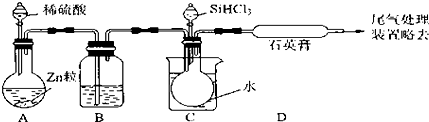

 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C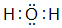 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.