题目内容
2.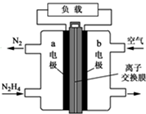 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:①该燃料电池中正极通入的物质是空气或氧气
负极发生的反应式为N2H4+4OH--4e-=N2+4H2O
②电池工作时,OH-移向极a(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼40g.
分析 ①燃料电池的正极是氧气在正极发生还原反应,是负极发生氧化反应,是肼在反应,注意电解质溶液的酸碱性即可;
②原电池中阴离子移向负极;
③据负极电极反应式计算消耗燃料肼的质量.
解答 解:①燃料电池的正极是氧气在正极发生还原反应,负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,
故答案为:空气或氧气;N2H4+4OH--4e-=N2+4H2O;
②原电池中阴离子移向负极,a为负极,所以电池工作时,OH-移向a电极,
故答案为:a;
③负极电极反应式为N2H4+4OH--4e-=4H2O+N2↑,转移4mol电子时消耗肼32g,则转移5mol电子消耗肼32g×$\frac{5}{4}$=40g,
故答案为:40.
点评 本题考查了原电池原理的应用,题目难度中等,侧重于考查学生对原电池原理的应用能力,注意把握燃料电池的电极的判断方法和电极方程式的书写方法,

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 11.2 L NH3中所含的原子数为2NA | |
| B. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
8.用接触法制5t98%的浓硫酸,在理论上需要FeS270%(杂质不含碳元素)的硫铁矿为( )
| A. | 86t | B. | 8.6t | C. | 4.3t | D. | 43t |
17.50mL 1mol/L氯化铝溶液中c(Cl-)相等的是( )
| A. | 150ml 1mol/L氯化钠溶液 | B. | 150ml 3mol/L氯化钾溶液 | ||
| C. | 75ml 2mol/L氯化铵溶液 | D. | 50ml 1mol/L氯化钡溶液 |
7.高中化学学习过程中的物质颜色是需要注意的.下列关于颜色的描述正确的个数是
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成浅黄色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色( )
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成浅黄色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
11.下列分子式表示的物质一定是纯净物的是( )
| A. | C5H10 | B. | C4H8 | C. | C2H4 | D. | C2H4Cl2 |
12.下列各组物质在反应时生成白色烟的是( )
| A. | 氢气在氯气中燃烧 | B. | 钠在氯气中燃烧 | ||
| C. | 氢气在氧气中燃烧 | D. | 细铁丝在氯气中燃烧 |
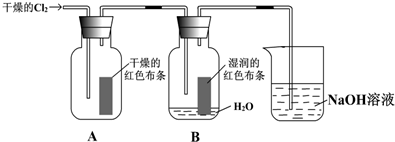
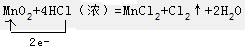
 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.