题目内容
10.某同学设计了有关氯气的实验: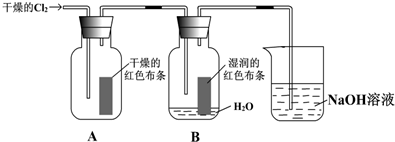
(1)写出实验室制备Cl2的离子方程式,并用单线桥分析电子的转移:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O、
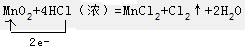
(2)装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色,用发生反应的化学方程式和必要的文字叙述解释现象干燥Cl2没有漂白性,Cl2与水反应生成HClO有漂白性,Cl2+H2O?HCl+HClO.
(3)上述装置烧杯中盛放溶液的作用是吸收尾气,防止污染空气.
(4)Fe在Cl2中燃烧,生成棕红色的烟,其溶液中存在Fe3+,向溶液中加入适量量铜粉恰好完全反应,溶液变色,发生的化学反应方程式为2Fe3++Cu=2Fe2++Cu2+,后再加氯水,溶液颜色再次发生变化,原因是(用离子方程式表示)2Fe2++Cl2=3Fe2++2Cl-.
分析 (1)Mn元素的化合价由+4价降低为+2价,该反应中转移2e-,转移电子为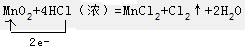 ;
;
(2)Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,则集气瓶B中湿润的红色布条褪色;
(3)氯气有毒,与氢氧化钠溶液反应,从而达到吸收尾气的作用;
(4)铁离子与铜单质发生氧化还原反应,离子反应方程式为:2Fe3++Cu=2Fe2++Cu2+;亚铁离子被氧化成铁离子,离子反应方程式为:2Fe2++Cl2=3Fe2++2Cl-.
解答 解:(1)Mn元素的化合价由+4价降低为+2价,该反应中转移2e-,转移电子为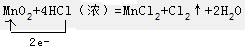 ;
;
故答案为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O;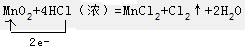 ;
;
(2)Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,则集气瓶B中湿润的红色布条褪色,故答案为:褪色;干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性,Cl2+H2O?HCl+HClO;
(3)氯气有毒,与氢氧化钠溶液反应,从而达到吸收尾气的作用,故答案为:吸收尾气,防止污染空气;
(4)铁离子与铜单质发生氧化还原反应,离子反应方程式为:2Fe3++Cu=2Fe2++Cu2+;亚铁离子被氧化成铁离子,离子反应方程式为:2Fe2++Cl2=3Fe2++2Cl-,故答案为:2Fe3++Cu=2Fe2++Cu2+; 2Fe2++Cl2=3Fe2++2Cl-.
点评 本题考查HClO的漂白性的探究,题目难度不大,本题注意氯气与次氯酸性质的差异性,注意有关反应化学方程式或者离子方程式的书写,把握反应的原理.

练习册系列答案
相关题目
15.维生素A的结构简式如图所示,关于它的叙述中正确的是( )


| A. | 维生素A属于烃 | |
| B. | 维生素A能发生取代、加成、酯化反应 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A不能与金属钠反应产生氢气 |
16.将氯化钠、氯化亚铁、氯化铁、氯化镁四种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
13.有KAl(SO4)2和K2SO4的混合溶液aL将它均分成两份,一份滴加BaCl2稀溶液,使SO42-离子完全沉淀,另一份滴加KOH溶液,使Al3+离子先沉淀后又恰好溶解,反应中消耗xmolBaCl2、ymolKOH,据此得知原混合溶液中的c(K+)/mol•L-1为( )
| A. | $\frac{4x-2y}{a}$ | B. | $\frac{2x-y}{a}$ | C. | $\frac{8x-3y}{2a}$ | D. | $\frac{8x-3y}{a}$ |
19.两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
| A. | CH4 C2H4 | B. | CH4 C3H4 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
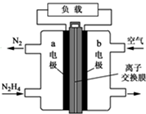 肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题:
肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如上图所示,回答下列问题: