题目内容
10.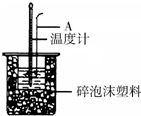 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和.
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?不断读取温度数据,并记录,直到出现下降,取最大值.
分析 (1)仪器A的名称环形玻璃搅拌棒;
(2)为了确保定量的硫酸反应完全,所用NaOH稍过量;
(3)将NaOH溶液倒入小烧杯中,不能分几次倒入,否则会导致热量散失,影响测定结果;
(4)硫酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(5)先判断温度差的有效性,然后求出温度差平均值,然后根据公式Q=△H=△Tcm来计算反应的焓变,并根据热化学方程式的书写方法来写热化学方程式;
(6)a.实验装置保温、隔热效果差,热量散失较大;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大;
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高;
(7)不断读取温度数据,并记录,直到出现下降.
解答 解:(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)实验中,所用NaOH稍过量的原因是确保定量的硫酸反应完全,
故答案为:确保硫酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,
故答案为:B;
(4)使硫酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,
故答案为:用环形玻璃棒轻轻搅动;
(5)第1次实验H2SO4和NaOH溶液起始平均温度为25.1℃,反应后温度为28.5℃,反应前后温度差为3.4℃;
第2次实验H2SO4和NaOH溶液起始平均温度为25.0℃,反应后温度为28.3℃,反应前后温度差为3.3℃;
第3次实验H2SO4和NaOH溶液起始平均温度为26.0℃,反应后温度为31.8℃,反应前后温度差为5.8℃;
第4次实验H2SO4和NaOH溶液起始平均温度为25.5℃,反应后温度为29.0℃,反应前后温度差为3.5℃;
第3次实验误差较大,舍去,其他三次实验的平均值为$\frac{3.4+3.3+3.5}{3}$℃=3.4℃,Q=△H=-△Tcm=-3.4℃×4.18J/(g•℃)×100mL×1g/mL═1.4212kJ/mol,50moL 0.25mol•L-1硫酸与50mL 0.55mol/L NaOH溶液的中和反应生成水的物质的量是0.025mol,所以生成2mol水放出的热量为:$\frac{1.4212kJ}{0.025mol}$×2=113.7kJ•mol-1,所以热化学方程式为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1,
故答案为:H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1;
(6)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确.
故答案为:abc;
(7)不断读取温度数据,并记录,直到出现下降,取最大值即为混合液的最高温度;
故答案为:不断读取温度数据,并记录,直到出现下降,取最大值.
点评 本题考查热化学方程式以及反应热的测定与计算,题目难度大,注意理解测定原理、把握热化学方程式的书写方法等问题.

 金钥匙试卷系列答案
金钥匙试卷系列答案Ⅰ.为探究影响H2O2分解速率的因素,某实验小组进行了如下实验:
实验1:在相同的条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象.
实验2:
将质量相同但状态不同的MnO2分别加入盛有15mL5%的H2O2溶液的大试管中,并用带火星的木条测试,实验结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)H2O2的分解反应是放热反应(填放热或吸热).
(2)实验1的目的是研究FeCl3对H2O2分解反应速率的影响,加入1mLH2O的作用是保持两支试管中H2O2的浓度相等.
(3)实验2的实验结果表明,催化剂的催化效果与催化剂接触面积有关.
(4)实验室检验Fe3+的实验方法是取少量的FeCl3溶液于试管中,加入几滴KSCN溶液,溶液显血红色.
Ⅱ.一条件下,H2O2在水溶液中发生复分解反应的过程中,实验测得不同时间H2O2的物质的量浓度如下表:
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)如果反应所用的H2O2溶液为200mL,则0~80min共产生O22.4g.(写出计算过程)
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
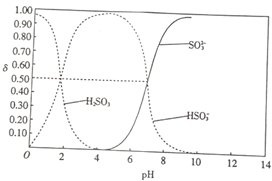 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C2H6O溶于水后均不导电 | P4O10、C2H6O均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该烃分子中有碳碳双健 | |
| B. | 该烃分子中有碳碳三健 | |
| C. | 该烃的分子结构可能有两种 | |
| D. | 该烃分子中所有原子可在同一平面上 |
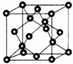 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.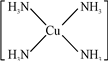 2+.
2+.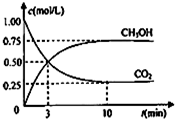 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料, 负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空