题目内容
5.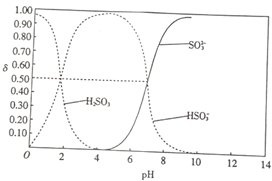 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
分析 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,发生的反应为:H2SO3+NaOH=NaHSO3,NaHSO3+NaOH=Na2SO3+H2O
A.含硫酸物质的分布分数δ为0.50时c(H2SO3)=c(HSO3-);
B.PH=6时溶液中主要的离子是HSO3-和SO32-,溶液显酸性;
C.pH=7.19时溶液中为Na2SO3和HNaHSO3的混合溶液,溶液中存在电荷守恒;
D.加入150mLNaOH溶液时溶液中为Na2SO3和NaOH的混合溶液,溶液中存在物料守恒分析判断;
解答 解:A.含硫酸物质的分布分数δ为0.50时c(H2SO3)=c(HSO3-),pH=1.85,故A正确;
B.PH=6时溶液中主要的离子是HSO3-和少量SO32-,溶液显酸性,c(Na+)>c(HSO3-)>c(SO32-),故B正确;
C.pH=7.19时溶液中为Na2SO3和HNaHSO3的混合溶液,溶液中存在电荷守恒c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故C正确;
D.加入150mLNaOH溶液时溶液中为Na2SO3和NaOH的混合溶液,溶液中存在物料守恒分析可知3c(Na+)>2c(H2SO3)+2c(HSO3-)+2c(SO32-),故D错误;
故选D.
点评 本题考查了离子浓度大小比较,电解质溶液中电荷守恒、物料守恒的分析判断,注意曲线变化的特征和溶液成分判断,掌握基础是解题关键,题目难度较大.

练习册系列答案
相关题目
15.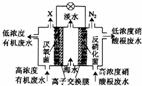 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法错误的是( )| A. | 中间室中的 Cl-向左室移动 | |
| B. | 左、右两室溶液混合后所得溶液的酸性:反应前<反应后 | |
| C. | X气体为CO2 | |
| D. | 左边离子交换膜为阴离子交換膜,右边离子交换膜为阳离子交換膜 |
16.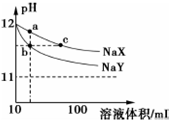 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
 常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )
常温下,体积均为10mL、pH均为12的NaX和NaY两种钠盐溶液,分别加水稀释,pH随溶液体积的变化如图所示.下列叙述错误的是( )| A. | 相同温度下,电离平衡常K(HX)<K(HY) | |
| B. | b、c两点溶液中水的电离程度相同 | |
| C. | a点溶液中:c(H+)+c(HX)=c(OH-) | |
| D. | b、c两点溶液中Na+的物质的量:nb(Na+)<nc(Na+) |
13.某主族元素M的最高正化合价与负化合价代数和为2,下列叙述正确的是( )
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
20.可燃冰是一种天然气水合物,其主要成分为CH4•nH2O,分布于深海沉积物或陆域的永久冻土中,下列有关说法正确的是( )
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
10.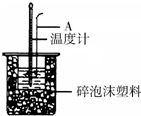 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和.
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?不断读取温度数据,并记录,直到出现下降,取最大值.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因确保硫酸被完全中和.
(3)加入NaOH溶液的正确操作是B(填字母).
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃棒轻轻搅动.
(5)设溶液的密度均为1g•cm-3,中和后溶液的比热容c=4.18J•(g•℃)-1,请根据实验数据写出该中和热的热化学方程式H2SO4(aq)+2NaOH(aq)Na2SO4(aq)+2H2O(l)△H=-113.7kJ•mol-1
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 28.5 | ||
| 2 | 24.9 | 25.1 | 28.3 | ||
| 3 | 25.5 | 26.5 | 31.8 | ||
| 4 | 25.6 | 25.4 | 29.0 | ||
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?不断读取温度数据,并记录,直到出现下降,取最大值.
17.根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
14.表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图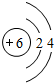
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为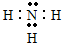
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)举一例说明C和I金属性的强弱Na与冷水剧烈反应,Mg与沸水缓慢反应
(7)用电子式表示由I和H组成的化合物的形成过程 .
.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
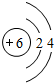
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于)
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
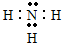
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O=H++Cl-+HClO
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)举一例说明C和I金属性的强弱Na与冷水剧烈反应,Mg与沸水缓慢反应
(7)用电子式表示由I和H组成的化合物的形成过程
 .
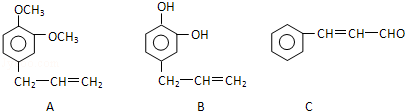
. 
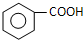 +
+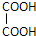 则C9H8O的结构简式为
则C9H8O的结构简式为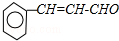 .
.